С уксусной кислотой магний будет реагировать чем с серной
Гидропоника
Авторская программа Шульгина Александра Терентиевича
Sample menu:
Клуб «Юный химик»: Магний + уксусная кислота// Химия и жизнь. 1989. 2.
ИТОГИ КОНКУРСА
Сегодня мы обсуждаем пятое, последнее задание прошлогоднего конкурса.
Предварительные опыты показали: скорость растворения растёт с увеличением поверхности металла, что, в общем-то, и следовало ожидать. Кусочек магния весом 22, 4 мг и с площадью поверхности 7 0 мм 2 растворился за 75 0 с, а при площади 11 0 мм 2 за 45 3 с. Поэтому для опытов с кислотой разной концентрации ребята брали кусочки магния примерно равной площади.
Сам Аррениус считал, что ионы движутся в растворах хаотически примерно так, как молекулы в газах. Все формулы, выведенные на основе теории Аррениуса, будут справедливы лишь для таких идеальных растворов. Однако вспомним, что даже газы, состоящие из нейтральных и относительно слабо взаимодействующих молекул, при повышенных давлениях перестают подчиняться уравнениям идеальных газов. Тем более это относится к растворам электролитов. В таком растворе каждый ион притягивает к себе ионы противоположного знака и как бы окружает себя ионной атмосферой, плотность которой увеличивается с концентрацией. Кроме ионов, взаимодействуют друг с другом и недиссоциированные молекулы кислоты, образуя димеры, а это затрудняет их диссоциацию.
В таких случаях, как справедливо отмечают члены химического кружка из Ялты, вместо концентраций ионов в формулах надо использовать активности. это такая величина, подстановка которой вместо концентрации в уравнения для идеального раствора, делает эти уравнения применимыми для данного раствора. Для очень сильно разбавленных растворов активности совпадают с концентрациями, но чем сильнее раствор отличается от идеального, тем больше отличаются эти величины, для концентрированных растворов сильных кислот они могут отличаться в сотни раз.
Посмотрим теперь, что будет, если в раствор электролита опустить электроды и подать на них напряжение. Под действием электрического поля каждый ион начинает двигаться в одну сторону, а его ионная атмосфера в противоположную. Это создает сильное «трение», оно тормозит движение ионов и снижает их подвижность. Чем больше концентрация, тем плотнее ионная атмосфера, тем сильнее тормозящий эффект. Движение ионов затрудняется и вязкостью раствора, которая также растёт с концентрацией. В случае уксусной кислоты вязкость растворов повышается почти в 3 раза при увеличении концентрации от 1 до 80%.
Всё сказанное имеет самое непосредственное отношение не только к электропроводности, но и к скорости реакции кислоты с металлом. Ялтинские школьники показали, что при перемешивании 2, 5 М раствора кислоты скорость растворения заметно увеличивается: ведь перемешивание как бы искусственно повышает подвижность ионов водорода. Увеличивается скорость и при повышении температуры примерно в 10 раз, если раствор нагреть от комнатной температуры до 7 3 °С.
Мы разобрали все задания конкурса. Многие его участники писали, что они с большим удовольствием приняли в нём участие. Желаем всем успехов в новом конкурсе, условия которого помещены в № 12, 1988 и № 1, 198 9 г.
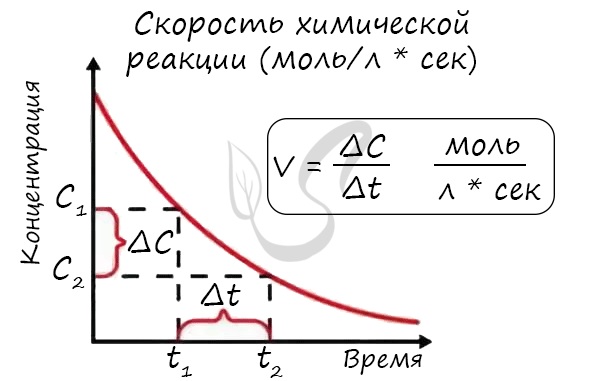
Скорость химической реакции
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в другое в единице объема.
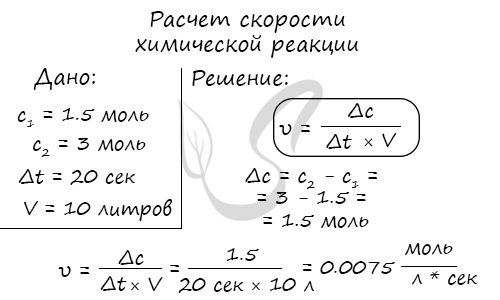
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость реакции. Давайте решим подобное несложное задание для примера:
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.
Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения реагирующих веществ.
Химическая активность также играет важную роль. Например, отвечая на вопрос: какой из металлов Li или K быстрее прореагирует с водой? Мы отдадим предпочтение литию, так как в ряду активности металлов он стоит левее калия, а значит литий активнее калия.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.
Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции aA + bB → cC определяют по уравнению:
Записанное выше следствие закона действующих масс нужно не только «зазубрить», но и понять. Поэтому мы решим пару задач, где потребуется написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции, если объемы системы уменьшить в три раза?
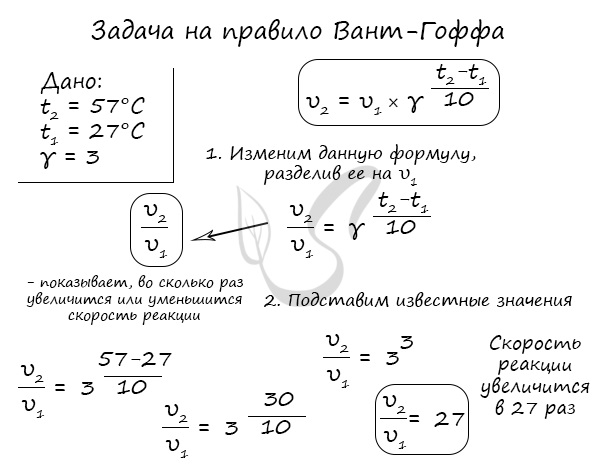
По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?
В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
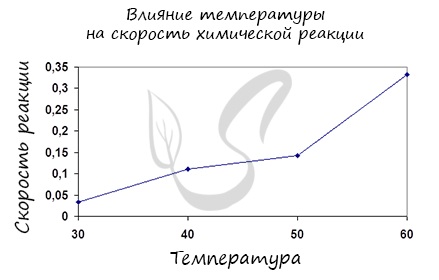
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: «Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как экзотермической, так и эндотермической. Исключений нет!»
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: «При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза»
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку. Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: «Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз».
Катализаторы и ингибиторы
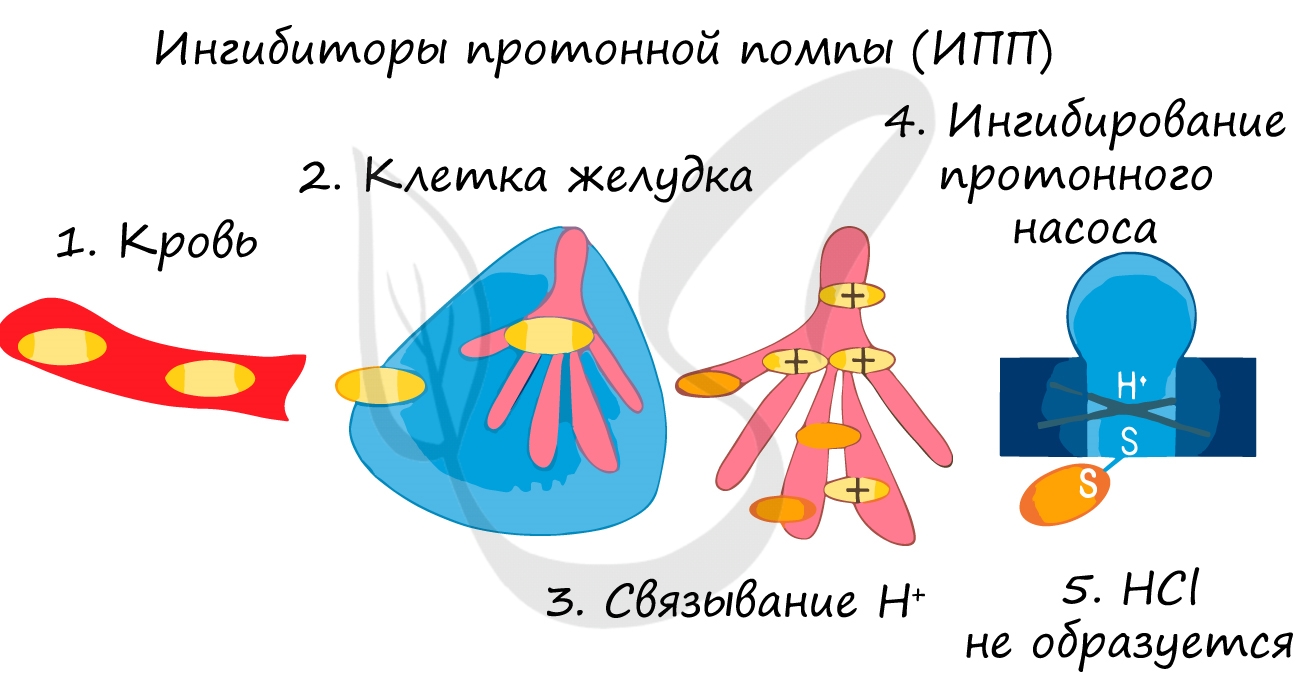
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества являются ингибиторами.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Скорость химической реакции
Серная кислота
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравнения реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800 о С |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3): Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
Химические свойства
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
4. Т акже серная кислота вступает в обменные реакции с солями.
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
Практическая работа №2. Влияние различных факторов на скорость химической реакции. Химия 11 класс
Практическая работа №2
Влияние различных факторов на скорость химической реакции.
Цель: рассмотреть влияние различных факторов на скорость химической реакции.
Оборудование и реактивы: пробирки, спиртовка, спички, держатель, штатив для пробирок, лучинка, цинк, магний, медь: гранулы и порошок, растворы соляной кислоты (1:3, 1:10), уксусная кислота, мел, стакан с горячей водой, пероксид водорода, оксид марганца ( IV ).
Оформить работу в виде таблицы:
Рассматриваемый фактор, влияющий на скорость химической реакции
Наблюдения, позволяющие судить о скорости реакции
1. Влияние природы реагирующих веществ
В первой пробирке (магния) наблюдается активное выделение газа (водорода)
Во второй пробирке (где цинк) медленно выделяются пузырьки газа (водорода)
В третей пробирке (где медь) ничего не наблюдается
Cu + HCl ↛ реакция не идет
С цинком быстрее протекает реакция с соляной кислотой, чем с уксусной кислотой
2. Влияние концентрации реагирующих веществ
Где более интенсивно проходит реакция? Почему?
Там, где концентрация кислоты больше (1:3), там реакция идет быстрее, чем где концентрация кислоты составляет 1:10.
В двух пробирках идет одна и та же реакция:
Zn + 2HCl → ZnCl 2 + H 2 ↑
Чем выше концентрация реагирующих веществ, тем чаще столкновения их частиц и тем выше скорость химической реакции
3. Влияние поверхности соприкосновения реагентов
В одну пробирку опустите кусочек мела, в другую насыпьте порошок мела. Налейте в пробирку по 1,5 мл соляной кислоты одинаковой концентрации. Есть ли разница в скорости выделения газа?
Наиболее интенсивно газ выделяется, там где был порошок мела, нежели кусочек мела
В двух пробирках идет одна и та же реакция:
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 ↑
При увеличении степени измельчения твердых веществ, увеличивается поверхность соприкосновения реагирующих веществ, т. е. растет число столкновений между молекулами и или атомами поэтому, чем выше степень измельчения веществ, тем быстрее протекает скорость реакции
4. Влияние температуры
В две пробирки опустите по одной грануле цинка. Налейте по 1 мл соляной кислоты одинаковой концентрации в каждую пробирку. Одну пробирку опустите в стакан с горячей водой. По интенсивности выделения пузырьков водорода сделайте вывод о влиянии температуры на скорость химической реакции
Быстрее реакция идет там, где пробирка опущена в стакан с горячей водой
В двух пробирках идет одна и та же реакция:
Zn + 2HCl → ZnCl 2 + H 2 ↑
При столкновении молекул и/или атомов реагируют только те молекулы и/или атомы, которые обладают достаточной кинетической энергией для осуществления реакции. При повышении температуры доля таких молекул и/или атомов возрастает, поэтому в пробирке, которая опущена в стакан с горячей водой, реакция идет более интенсивно
5. Влияние катализатора
В пробирку налейте 1 мл пероксида водорода и внесите тлеющую лучинку, не прикасаясь к жидкости. Что наблюдаете? Добавьте к пероксиду водорода несколько кристалликов оксида марганца
Под действием катализаторов вещества становятся реакционно способными при более низкой температуре
Вывод: Скорость химической реакции зависит от условий: от природы реагирующих веществ, от площади соприкосновения, от концентрации, от температуры, от присутствия катализаторов.
Правила техники безопасности при выполнении химического эксперимента
Многие вещества при попадании на кожу могут вызвать ожоги. Никогда не берите вещества руками.
Некоторые вещества имеют неприятный запах, а их пары могут вызвать отравление. Не подносите близко к лицу открытую склянку.
В химической лаборатории не пробуют на вкус даже известные вещества, они могут содержать примеси, ядовитые для человека.
Кислоты – едкие вещества. Разрушают и раздражают кожу, слизистые оболочки.
Если кислота или щёлочь попала на кожу, её надо немедленно промыть большим количеством проточной воды.
7. Зажигать спиртовку только спичками, гасить крышкой или колпачком, накрывая сверху.
8. Запрещается передавать зажжённую спиртовку и зажигать одну спиртовку от другой.
9. При нагревании вещества в пробирке её необходимо сначала прогреть, отверстие пробирки во время нагревания должно быть направлено от себя и соседа.
10. Стекло – хрупкий материал, имеющий малое сопротивление при ударе и незначительную прочность при изгибе. Категорически запрещается использовать посуду, имеющую трещины и отбитые края.
11. Пробирку закрепляют в держателе так, чтобы от горлышка пробирки до держателя было расстояние 1 – 1, 5 см.
12. Опыты проводить с таким количеством веществ, которые указаны в методическом руководстве по проведению каждого опыта.
13. Без разрешения учителя, ничего на столах не трогать.
14. Во время проведения эксперимента или оформлении отчёта соблюдайте тишину.
15. После работы приведи порядок на рабочем месте.
С уксусной кислотой магний будет реагировать чем с серной
Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием простого вещества и солей. Запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Дан следующий перечень веществ: уксусная кислота, сульфат лития, перманганат натрия, карбонат натрия, серная кислота, иодид магния. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите сильный и слабый электролиты, между которыми возможна реакция ионного обмена, протекающая с образованием газа. Запишите молекулярное, полное и сокращённое ионные уравнения только одной возможной реакции.
Для начала запишем молекулярные формулы данных веществ:
,
Единственный слабый электролит в этом списке — уксусная кислота. Она реагирует с карбонатом натрия.