С чем взаимодействует амфотерный гидроксид
2.5. Характерные химические свойства оснований и амфотерных гидроксидов.
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2. Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних солей:
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.
Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000 o C:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 o C:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
Характерные химические свойства оснований и амфотерных гидроксидов
Содержание:
Первое знакомство с основаниями состоялось при изучении взаимодействия воды с активными металлами и с оксидами активных металлов. В состав оснований входит одновалентная группа атомов OH (гидроксогруппа). Следовательно, основаниям можно дать следующее определение:
Основания – сложные вещества, в состав которых входят атомы металлов, соединенные с одной или нескольким группами атомов OH.
Общая формула оснований выглядит следующим образом: Ме (ОН)x, где Ме – металл; x – индекс.
Номенклатура оснований
Название оснований включает в себя слово «гидроксид», названия металла и его валентности. Более того, для элементов с постоянной валентностью она не указывается.
Название основания = «Гидрооксид» + название Me + валентность (в скобках)
Классификация оснований
Все основания можно классифицировать по различным признакам. Рассмотрим это в нижеприведенной таблице.
Из таблицы мы видим, что наблюдается большое различие по некоторым признакам. В зависимости от этого, различные группы оснований, обладают не схожими химическими свойствами.
Химические свойства щелочей (Щ)
NaOH + HCl → NaCl + H2O
Химические свойства нерастворимых оснований
Химические свойства амфотерных гидроксидов
К амфотерным гидроксидам относятся сложные вещества, способные проявлять свойства кислот либо оснований при определенных условиях.
Формулы данных соединений можно представить в виде оснований и в виде кислот.
Важнейшие представители
Zn(OH)2 гидроксид цинка
Аl(ОН)3 гидроксид алюминия
Cr(ОН)3 гидроксид хрома (III)
Ве(ОН)2 гидроксид бериллия
Sn(OH)2 гидроксид олова (II)
Sn(OH)4 гидроксид олова (IV)
Pb(ОН)2 гидроксид свинца (II)
Pb(ОН)4 гидроксид свинца (IV)
Физические свойства
Все амфотерные гидроксиды представляют собой твердые вещества, плохо растворимые в воде.
Химические свойства
Проявляя свойства очень слабых оснований и очень слабых кислот, амфотерные гидроксиды взаимодействуют с сильными кислотами и с сильными основаниями (щелочами).
1. Основные свойства
В результате реакций с кислотами в раствор переходят катионы металлов, входящих в состав амфотерных гидроксидов.
2. Кислотные свойства
Co щелочами амфотерные гидроксиды могут взаимодействовать при высокой температуре в расплавах; при этом образуются соли, содержащие кислотные остатки метакислотных форм амфотерных гидроксидов.
При взаимодействии амфотерных гидроксидов с растворами щелочей образуются гидроксокомплексы с координационным числом, как правило, 4 или 6.
3. Термическое разложение
Как и нерастворимые основания, амфотерные гидроксиды разлагаются при нагревании (дегидратируются):
Способы получения
1. Подобно нерастворимым основаниям, амфотерные гидроксиды можно осаждать щелочами из растворов соответствующих солей, избегая избытка щелочи:
2. Амфотерные гидроксиды выделяются также в процессе разрушения гидроксокомплексов при действии кислот:
или при растворении в растворах кислот цинкатов, метаалюминатов и т. д.
Во всех этих реакциях следует брать строго рассчитанное количество кислоты, поскольку в избытке кислоты образующиеся амфотерные гидроксиды растворяются.
С чем взаимодействует амфотерный гидроксид
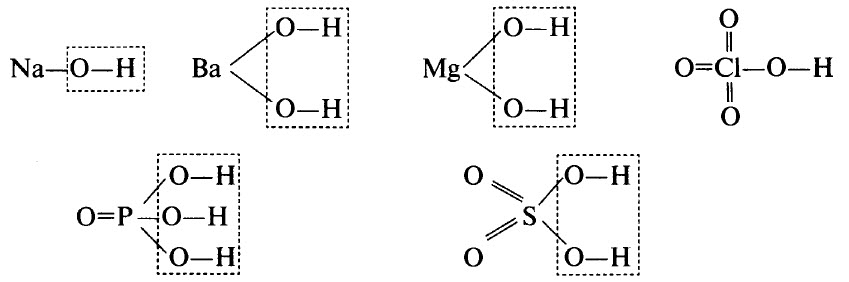
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Оксид и гидроксид цинка реагируют также и со щелочами:
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н + = Al 3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
В образовавшейся соли алюминий образует анион AlO2 – (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4] – :
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока по химии для 8 класса «Амфотерные оксиды и гидроксиды». Выберите дальнейшее действие:
Основания. Химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью:
Получение оснований
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий) , кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
2K 0 + 2 H2 + O → 2 K + OH + H2 0
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Химические свойства щелочей
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
А в растворе образуется комплексная соль:
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (к ак правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
щёлочь + кислотный оксид(избыток) = кислая соль
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Cu 2+ SO4 2- + 2Na + OH — = Cu 2+ (OH)2 — ↓ + Na2 + SO4 2-
Также щёлочи взаимодействуют с растворами солей аммония.
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
2NaOH +Cl2 0 = NaCl — + NaOCl + + H2O
6NaOH +Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O