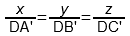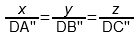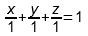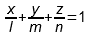Треугольник в химии для чего
ФАРФОРОВАЯ И ВЫСОКООГНЕУПОРНАЯ ПОСУДА Фарфоровая посуда
Ассортимент фарфоровой посуды, применяемой в обычных лабораториях, не так многочислен, как стеклянной. Фарфоровая посуда имеет ряд преимуществ перед стеклянной: она более прочная, не боится сильного нагревания, в нее можно наливать горячие жидкости, не опасаясь за целость посуды, и т. д. Недостатком изделий из фарфора является то, что они тяжелы, непрозрачны и значительно дороже стеклянных.
Рассмотрим наиболее часто применяемую в лабораториях фарфоровую посуду.
Стаканы — тех же видов и емкостей, что и стеклянные, (рис. 136).
Выпарительные чашки (рис. 137) широко применяются в лабораториях. Они бывают самых разнообразных емкостей, с диаметром от 3—4 до 50 см и больше.
Фарфоровые выпарительные чашки с носиком выпускаются следующих размеров:
Емкость, мл 28,8 65,0 140,0 311,0 471,0 1010,0 2106,0 4600,0 Высота, мм 56 72 93 120 156 202 260 366. Внутри они обязательно покрыты глазурью, снаружи глазурь доходит до 7з—7г высоты от края. Чашки служат для выпаривания разного рода растворов; хотя фарфоровые чашки можно нагревать на голом пламени, однако при выпаривании следует применять асбестиро-ванные сетки или водяные бани, так как нагревание в этом случае равномернее.
Ступки применяют для размельчения твердых веществ (см. гл. 9 «Измельчение и смешивание»).
Тигли (рис. 138)—фарфоровые сосуды с фарфоровыми крышками. Тигли для прокаливания (низкие) изготовляют следующих размеров:
В тиглях прокаливают разного рода вещества, ежи-‘ гают органические соединения при определении зольности и т. д. В большинстве случаев нагревание тиглей проводят прямо на горелке без применения асбестиро-ванных сеток или бань.
Для нагревания тигля его нужно ставить в фарфоровый треугольник (рис. 139). Последний делают из трех насаженных на проволоку фарфоровых трубок. Треугольник следует брать таких размеров, чтобы тигель, вставленный в него, выдавался наружу не более чем на 7з высоты.
Подогрев ведут постепенно. Вначале тигель нагревают над пламенем горелки (только горячим воздухом), затем постепенно его вводят в бесцветное пламя горелки и, наконец, помещают в ту или иную зону пламени в зависимости от требуемой температуры прокаливания. При этом рекомендуется с самого начала нагревания укрепить тигель на такой высоте, на которой он должен находиться в последний наиболее длительный период прокаливания. Вначале же, держа горелку в руке, регулируют расстояние пламени от дна тигля.
Такой способ подогрева в особенности важен при сжигании органических веществ. В большинстве случаев работы с тиглем последний должен быть закрыт крышкой на все время работы. Для наблюдения за ходом прокаливания или сжигания крышку периодически снимают при помощи тигельных щипцов или пинцета. После окончания прокаливания или сжигания горелку отставляют или гасят, дают тиглю остыть некоторое время, а затем помещают его в эксикатор.
Рис. 138. Фарфоровый тигель
Рис. 139. Фарфоровый треугольник для тиглей.
Фарфоровые тигли можно нагревать до температуры не выше 1200° С; такую температуру возможно получить, если прокаливание вести в муфельной печи. В фарфоровом тигле нельзя проводить сплавление с щелочным веществом, например с углекислым натрием, а также работать с фтористоводородной кислотой, так как фарфор при этом разрушается. Следует помнить, что новые, еще не разу не использованные тигли полезно предварительно промыть и прокалить.
Это необходимо потому, что при использовании новых фарфоровых тиглей, например для озоления природных органических веществ с целью количественного определения в их золе кальция, всегда получаются повышенные результаты. Это объясняется тем, что кальций из тигля переходит в золу, причем в зависимости от метода озоления (с применением окислителей или без них) ошибка может достигать 3—4 мг. Для того чтобы уменьшить ошибку и сделать ее постоянной, для подобных работ лучше использовать фарфоровые тигли, длительное время бывшие в употреблении, предварительно прокипятив их последовательно в разбавленной соляной кислоте (1 : 1), в 5 н. растворе NaOH и в дистиллированной воде. Таким же путем обрабатывают новые тигли.
Когда приходится работать с большим количеством тиглей, их необходимо предварительно переметить или пронумеровать специальной огнестойкой краской или чернилами. Метку следует ставить на неглазурованной части тигля, лучше всего на донышке. Состав такой краски или чернил указан в гл. 26 «Некоторые полезные рецепты».
Рис. 140. Подставки для тиглей.
При проведении массовых анализов бывает необходимым прокаливать одновременно несколько тиглей, например 8—10 штук. В подобных случаях следует применять подставки, рассчитанные на прокаливание одновременно до 10 тиглей. Эти подставки (рис. 140) изготовляют из жароупорных материалов. Из металлов для этой цели пригоден никель и жароупорные стали, из других материалов — огнеупорные глины, шамот и т. п. Подставку можно смонтировать также из фарфоровых трубок и толстой нихромовой проволоки. Каждое гнездо для тигля должно иметь предохранительное устройство из проволоки в форме треугольника. Прокаливаемые тигли помещают именно в эти треугольники.
Для получения правильных результатов анализа очень важным является продолжительность охлаждения фарфоровых тиглей в эксикаторе *. В случае, когда эксикатор заполнен тиглями, охлаждение их до момента взвешивания должно проводиться не менее 2 ч, так как при меньшем охлаждении возникает ошибка из-за разницы температуры весов и тиглей. Чтобы свести ошибку до минимума (0,16 мг), тигли в эксикаторе необходимо охлаждать не менее I1A ч, даже когда в эксикаторе находятся только два тигля. Если тигли выдерживать в эксикаторе 25—40 мин, как это обычно рекомендуют, разница в температуре весов и тиглей достигает 10° С, а ошибка взвешивания составляет 2—3 мг. Сократить время охлаждения тиглей можно: 1) охлаждением их на воздухе перед помещением в эксикатор; 2) уменьшением количества тиглей, одновременно устанавливаемых в эксикаторе, и 3) выдерживанием тиглей в витрине весов перед взвешиванием.
Установлено, что если температура внутри эксикатора была выше температуры весов, то это приводит к кажущемуся уменьшению массы тиглей, находившихся в эксикаторе, на 0,13 мг/град. Чтобы избежать этой температурной сшибки, рекомендуется в эксикатор помещать на специальной подставке небольшой термометр и сличать его показания с показаниями термометра в весовой комнате. Не рекомендуется также помещать в эксикатор одновременно больше 6 тиглей**.
* РЖХим, 1957, № 8, 286, реф. 27095. ** Halasowski Т., Przegl. glos. mlynarski, 2, № 6, 174 (1958); РЖХим, 1959, № 1, 162, реф. 1113.
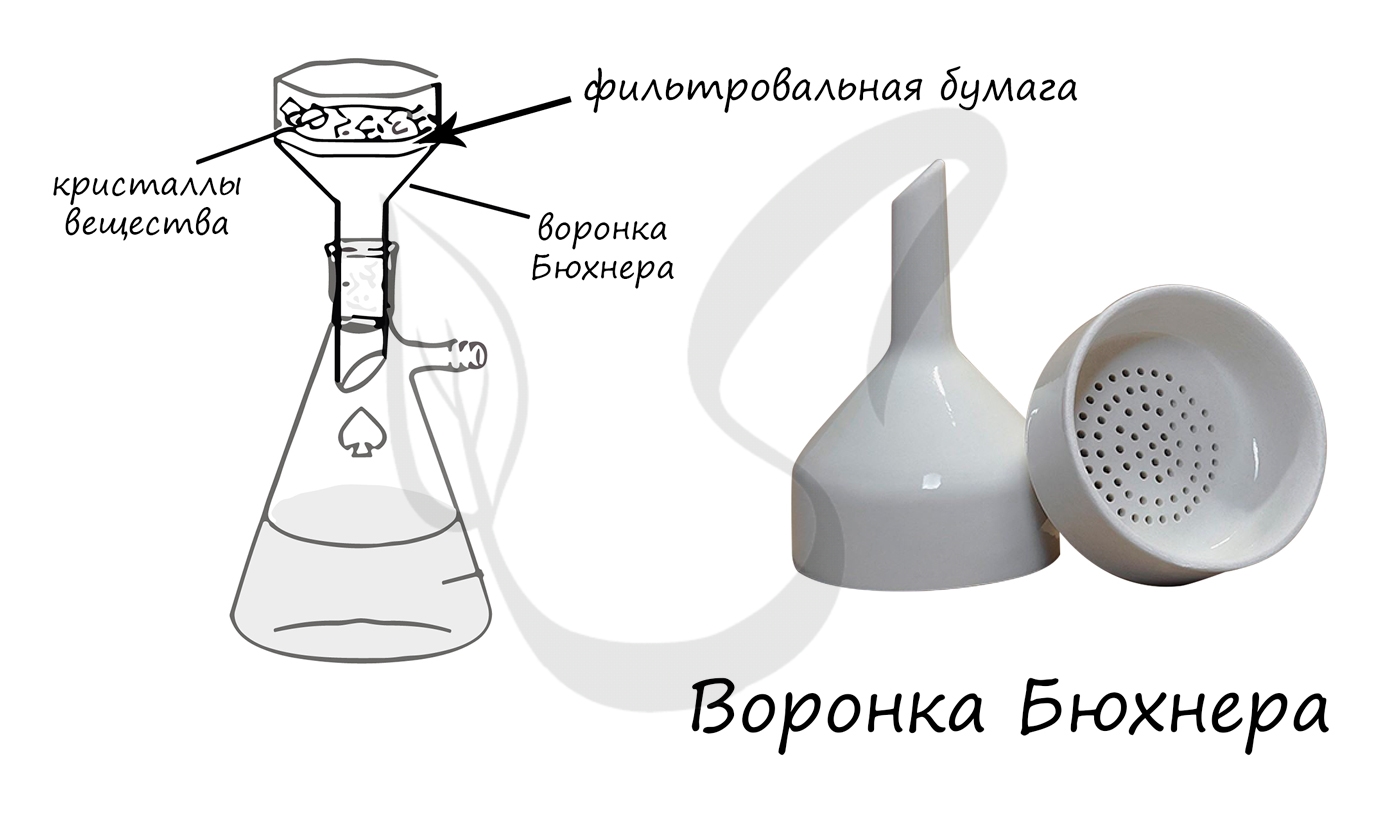
Когда кружки уложены в воронку, их следует слегка смочить дистиллированной водой или той жидкостью, которую будут фильтровать. При этом фильтровальная бумага плотно прижимается к сетчатой перегородке, что предотвращает попадание твердого вещества в фильтрат и между кружками (а следовательно, и потерю его).
Рис. 141. Фарфоровая воронка Бюхнера
Рис. 142. Фарфоровая сетка для фильтрования.
Кроме воронок Бюхнера, для фильтрования применяют фарфоровые сетки (рис. 142), которые кладут в обычную стеклянную воронку. Бумажные фильтры в этом случае должны иметь диаметр несколько больший, чем диаметр самой сетки, так чтобы при укладывании край их загибался на стенки воронки.
О фарфоровых нутч-фильтрах и о применении их см. гл. 11 «Фильтрование».
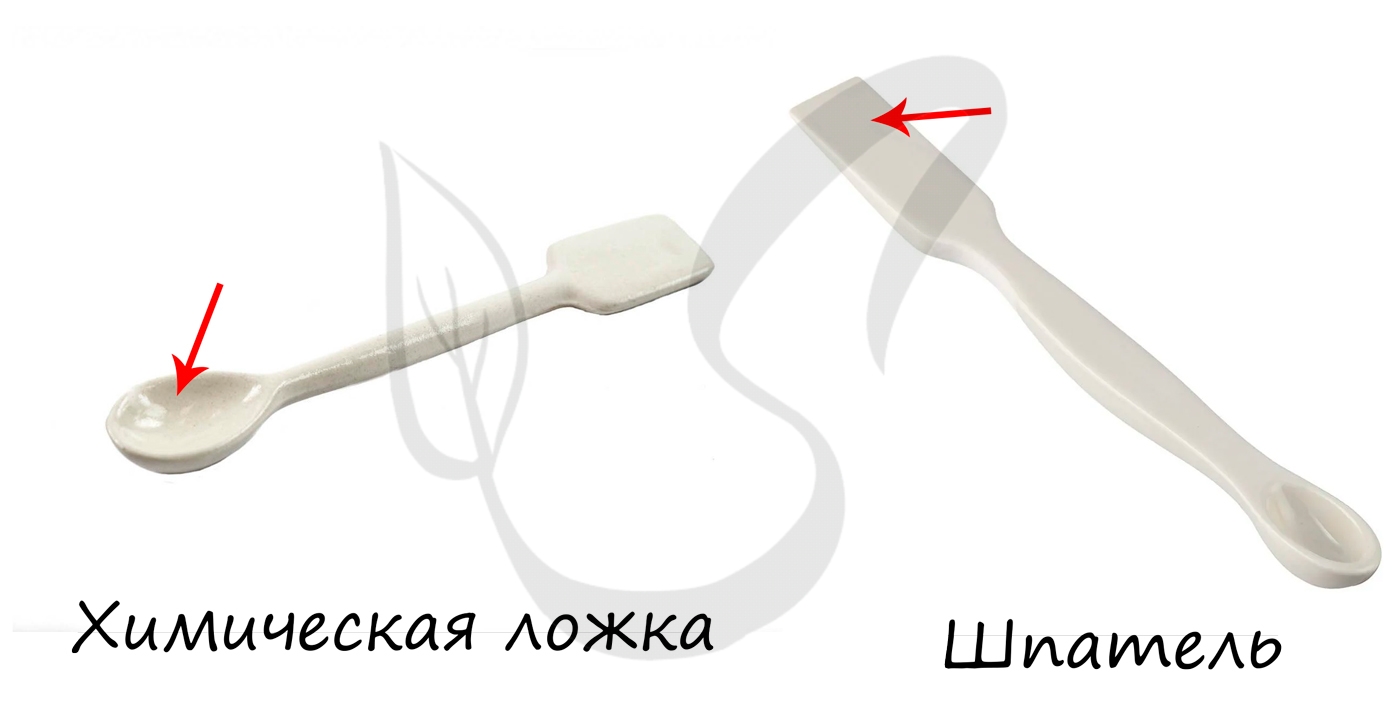
Ложки-шпатели (рис. 143) применяют в химических лабораториях для отбора вещества, для снятия осадков с фильтров и т. п,
Лодочки для прокаливания. Фарфоровые лодочки для прокаливания веществ при анализе (рис. 144) бывают различных размеров. Их не покрывают глазурью. На одном бортике лодочки имеется кольцо, за которое можно зааепнть крючком при вытаскивании лодочки ит печи.
Фарфоровые трубки, применяемые для лабораторных целей, также не бывают покрыты глазурью. Они имеют различные диаметры — от 2 до 50 мм и больше.
Рис. 143. Фарфоровая ложка- шпатель.
Рис. 144. Фарфоровая лодочка для прокаливания.
Тонкие трубки применяют как изоляторы проводов и для приготовления термопар. В последнем случае часто пользуются трубками с двумя каналами небольшого диаметра. Более широкие трубки выдерживают температуру до 1200° С, их применяют в качестве реакторов при синтезах. Обогрев их проводят в трубчатых печах.Лодочки для прокаливания. Фарфоровые лодочки для прокаливания веществ при анализе (рис. 144) бывают различных размеров. Их не покрывают глазурью. На одном бортике лодочки имеется кольцо, за которое можно зааепнть крючком при вытаскивании лодочки ит печи.
Лабораторная посуда
Требования, которым должна соответствовать химическая посуда:
В данной статье мы классифицируем всю химическую посуду на три группы по ее назначению: мерная, немерная и специального применения.
Мерная химическая посуда
Мерная посуда имеет точную градуировку, нагреванию ее не подвергают.
Пипетки служат для отбора жидкостей (до 100 мл) и газов (от 100 мл)
Применяются для измерения точных объемов, титрования (метод количественного/качественного анализа в аналитической химии)
С помощью мерных колб, мензурок и цилиндров отмеривают и хранят определенные объемы жидкостей.
Немерная химическая посуда (общего назначения)
К такой химической посуде относятся изделия, многие из которых употребляются с нагревом: пробирки, стаканы, колбы (плоскодонные, круглодонные, конические), реторты.
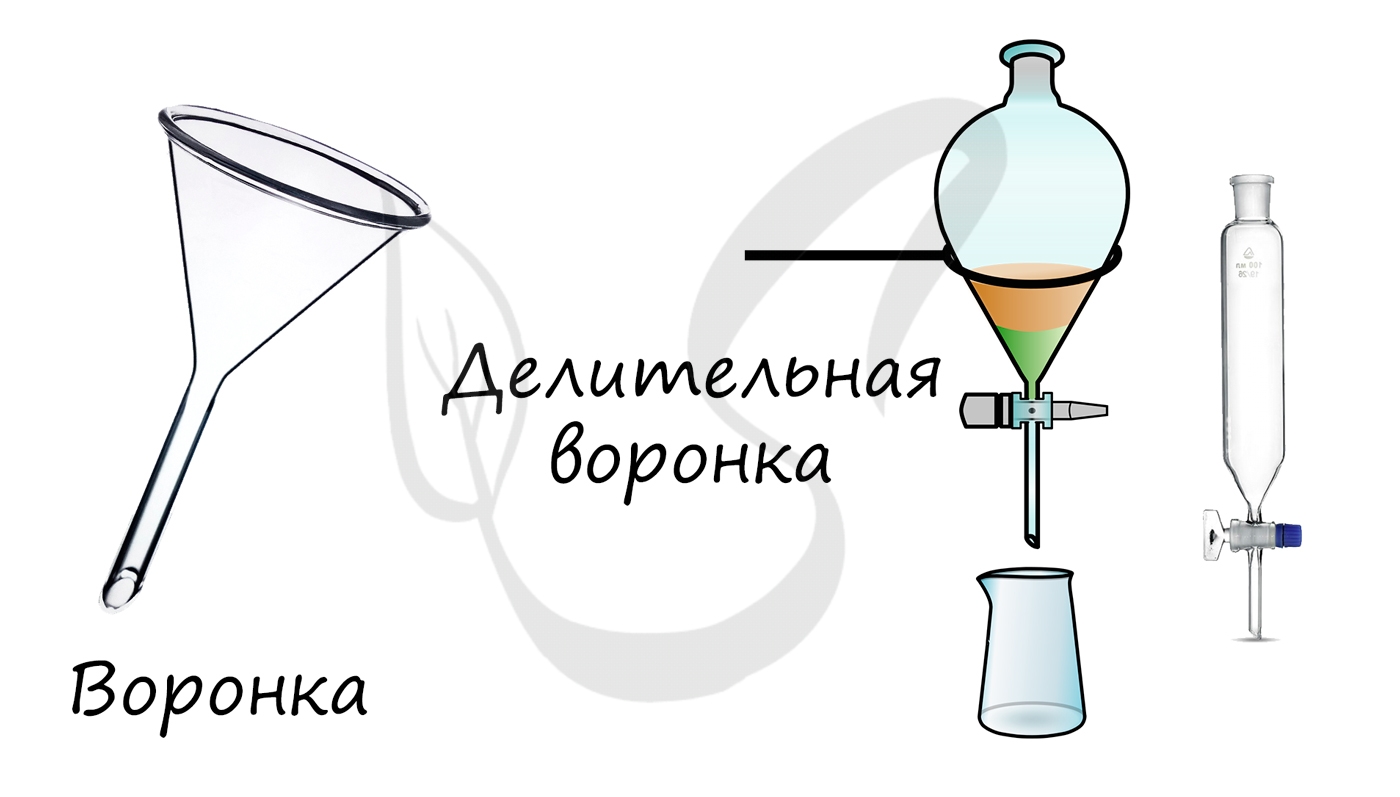
Служат для переливания и фильтрования жидкостей. Делительные воронки применяются для разделения несмешивающихся жидкостей.
Сифон химический применяется для безопасного перекачивания жидких сред из бутылей, бочек, канистр. Особенно важен сифон в работе с агрессивными опасными химическими веществами.
Химическая капельница применяется для дозирования растворов и индикаторов.
Используются с целью взятия твердых и сыпучих веществ. Могут служить для перемешивания жидкостей.
Применяется для одновременного размещения и закрепления множества пробирок.
Химическая посуда специального назначения
Данная посуда отличается тем, что предназначена для какой-либо одной цели.
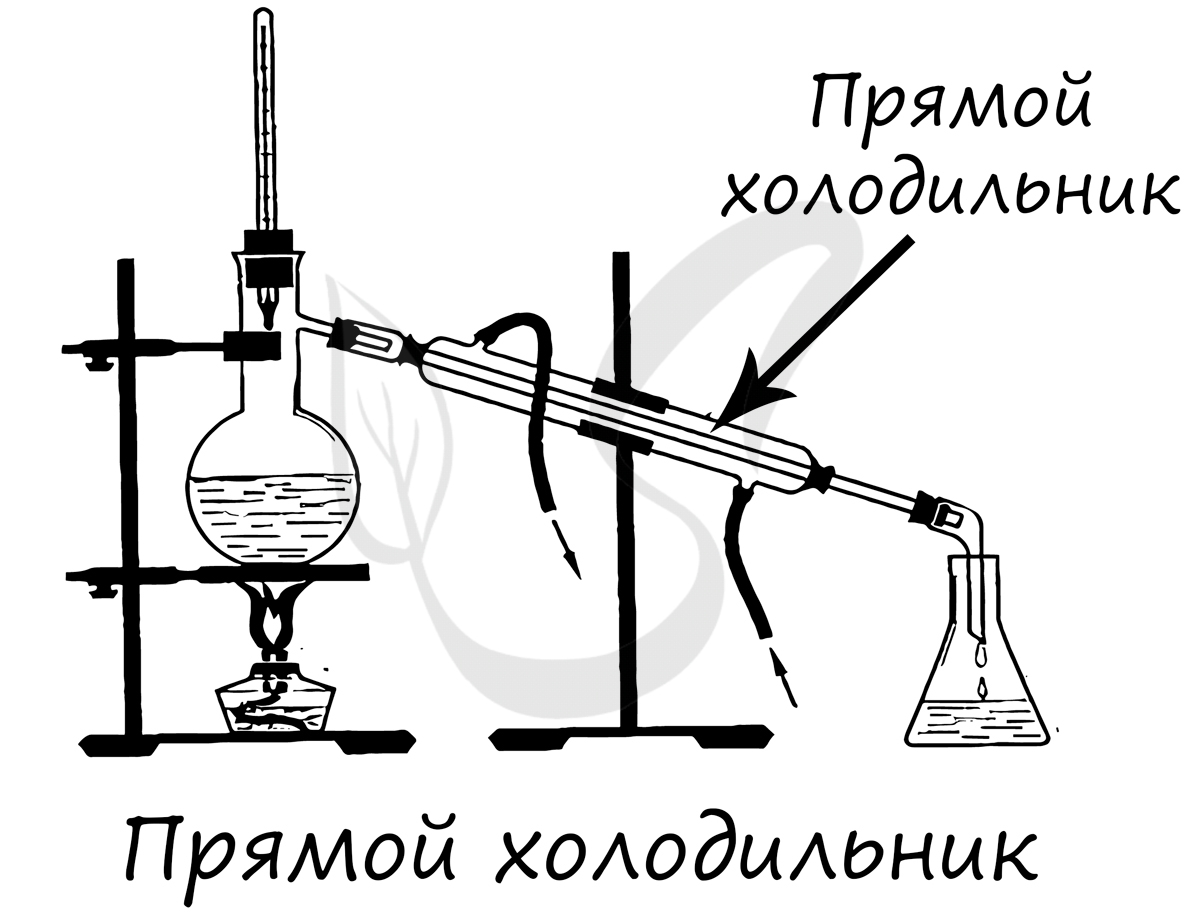
Круглодонная колба с отводом для вставки прямоточного холодильника. Используется для перегонки различных веществ.
Плоскодонная коническая колба, которая применяется для вакуумного фильтрования.
Применяется для фильтрования растворов при помощи фильтровальной бумаги под вакуумом.
Фильтр Шотта представляет собой стеклянную пористую пластинку. Фильтр Шотта используют в ходе вакуумного фильтрования.
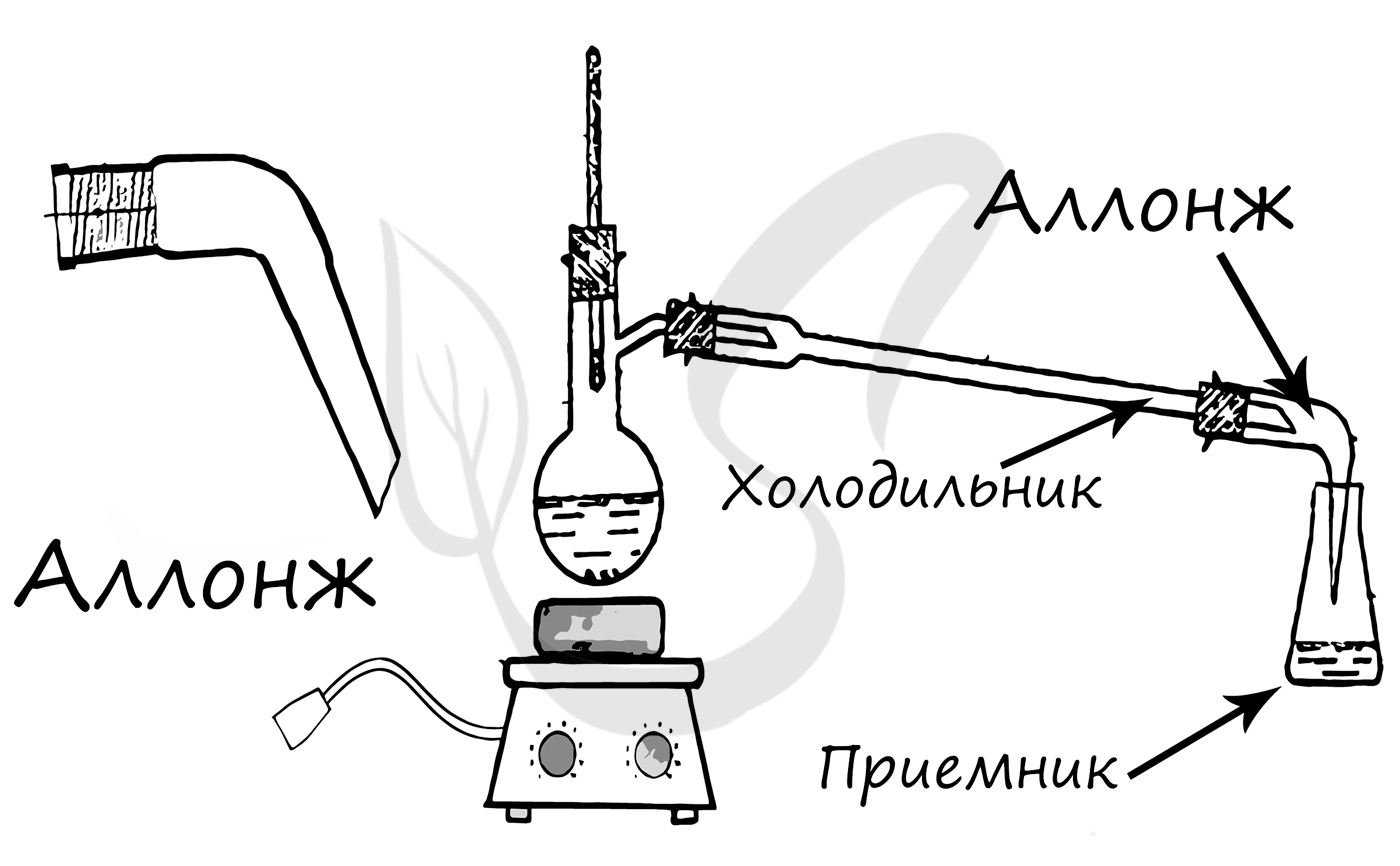
Применяется для конденсирования паров и отвода образовавшегося конденсата из системы, сбор конденсата происходит в колбу-приемник.
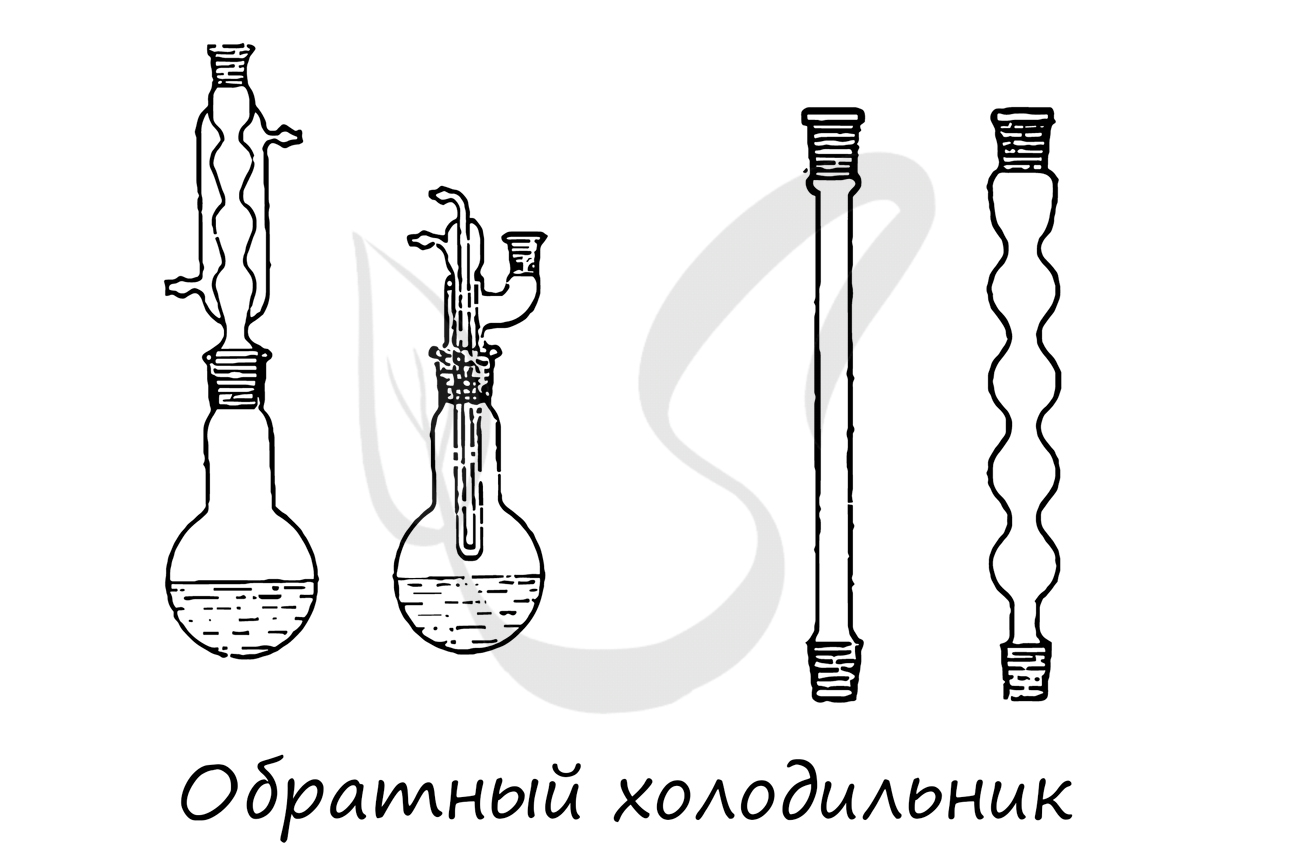
Применяется для конденсирования паров и возврата конденсата в реакционную массу. Обычно устанавливается вертикально.
Конструктивный элемент химических приборов, чаще всего используется для соединения холодильника с приемником.
Используется в качестве приемника при перегонке. Одним из предназначений колбы Кьельдаля является определения азота в веществах по методу Кьельдаля.
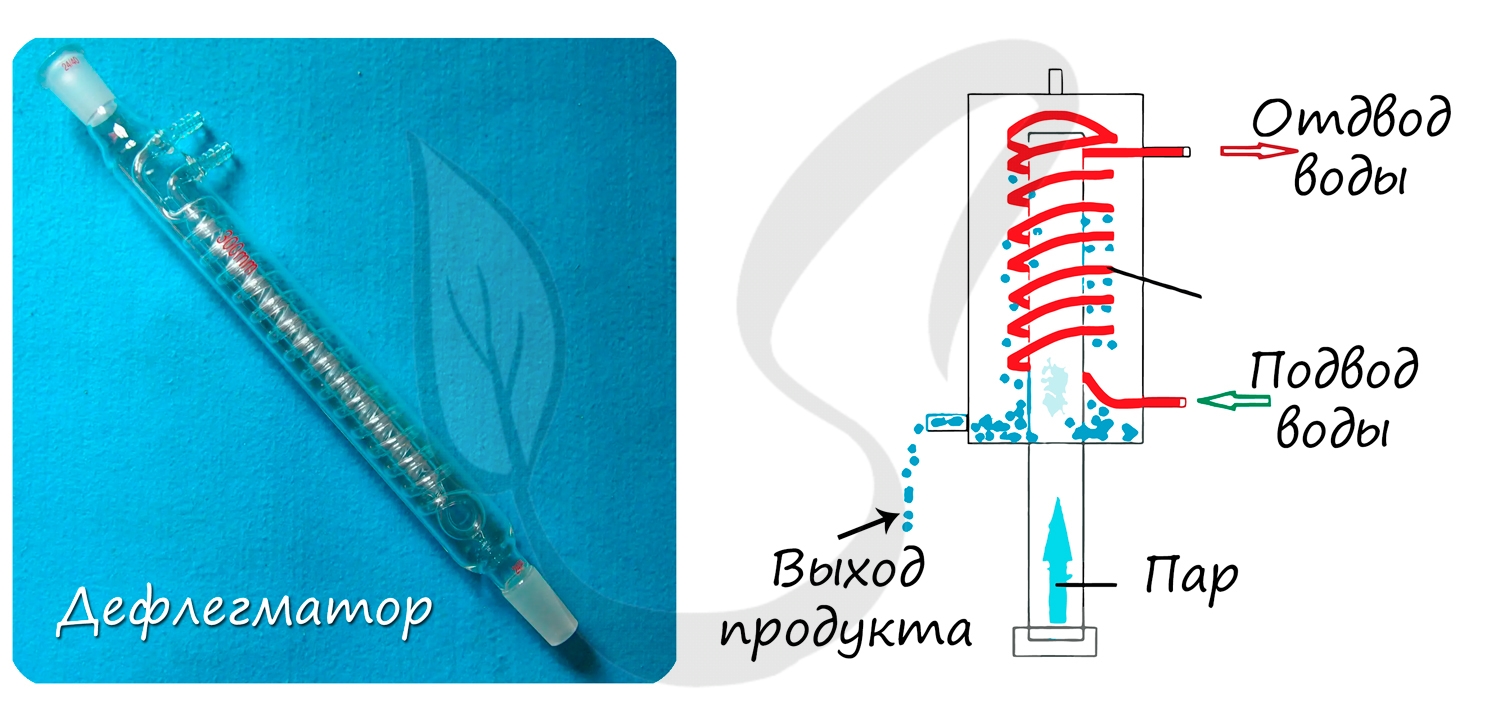
Используется для частичной или полной конденсации паров жидкостей, которые разделяют перегонкой или ректификацией (разделение, основанное на многократной дистилляции.)
Толстостенный стеклянный сосуд, с пришлифованной крышкой, на дно которого помещают влагопоглощающее вещество, в результате чего в эксикаторе поддерживается влажность воздуха приблизительно равная нулю. Эксикатор используется для высушивания и хранения различных веществ.
Служат для очистки газов от механических примесей. Также хлоркальцевые трубки применяют для предохранения растворов от попадания в них воды и углекислого газа: с этой целью их заполняют нужным поглотителем.
Применяется для получения газов при действии на твердые вещества растворов кислот и щелочей.
Чашки для выпаривания используют для выпаривания (упаривания) растворов.
Применяется для измельчения твердых веществ.
Применяются для прокаливания веществ в печи.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Треугольник в химии для чего
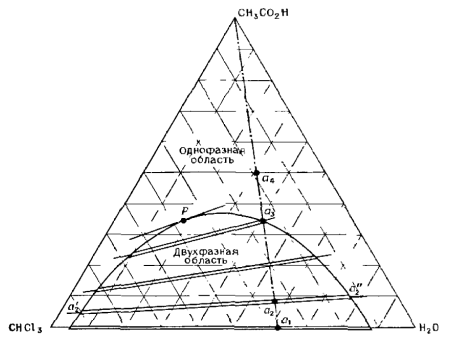
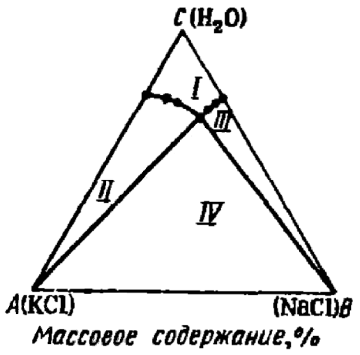
На третьем курсе на занятиях по физической химии мы изучали различные диаграммы состояния. Особо запомнились своим довольно необычным видом такие диаграммы при постоянных температуре и давлении для систем, состоящих из трёх веществ, так как изображались они в виде равностороннего треугольника (т. н. «треугольник Гиббса-Розебома»), где каждая его точка соответствовала смеси какого-либо определённого состава (рис. 1, 2), а концентрации выражались как доли компонентов.
Рис. 1. Трёхкомпонентная система уксусная кислота – хлороформ – вода при комнатной температуре [1, с. 338].
Рис. 2. Диаграмма растворимости KCl и NaCl в воде при 298 К [2, с. 485].
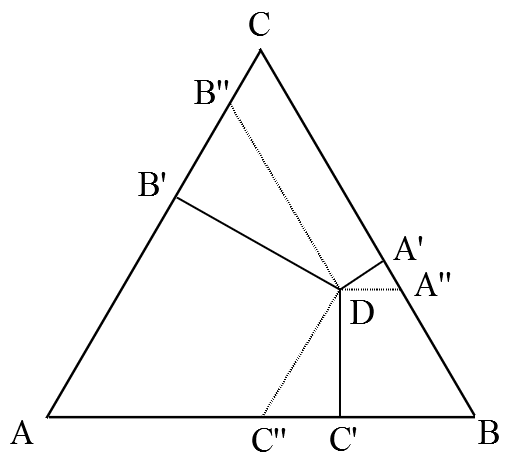
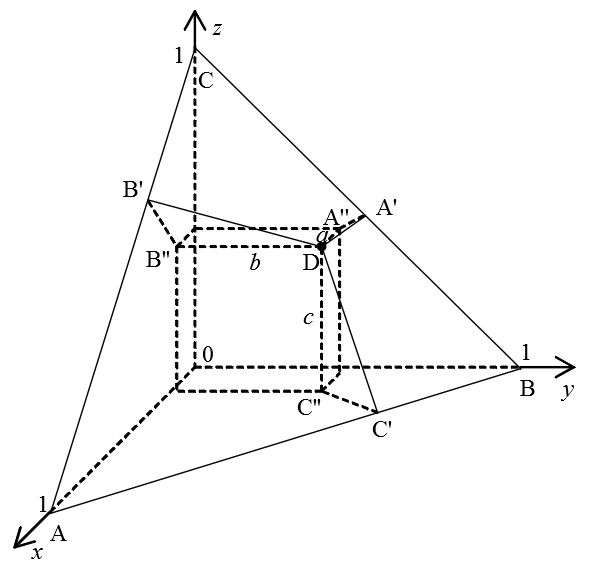
Рис. 3. Определение состава смеси по правилам Гиббса и Розебома.
1) По правилу Гиббса высота треугольника принимается за единицу (или за 100%) и используется тот факт, что сумма длин перпендикуляров, опущенных из точки D на стороны треугольника равна его высоте. В этом случае концентрации (доли) компонентов пропорциональны длинам этих перпендикуляров:
x : y : z = DA’ : DB’ : DC’
2) По правилу Розебома за единицу (за 100%) принимается длина стороны треугольника, при этом из точки D проводятся отрезки, параллельные каждой из его сторон (на рис. 3 это DA», DB», DC»). Сумма их длин равна стороне треугольника и выполняется следующее соотношение:
x : y : z = DA» : DB» : DC»
Легко видеть, что правила Гиббса и Розебома нисколько не противоречат друг другу:
x : y : z = DA’ : DB’ : DC’ = DA» : DB» : DC»
Это обусловлено тем, что △DA’A», △DB’B» и △DC’C» являются подобными (как треугольники с равными углами: ∠DA’A» = ∠DB’B» = ∠DC’C» = 90°; а ∠DA»A’ = ∠DB»B’ = ∠DC»C’ = 60°, поскольку DA» || AB, DB» || BC, DC» || AC).
Простого запоминания описанных правил вполне хватило для подготовки к сдаче экзамена, тем более дальнейшая жизнь сложилась так, что за все последующие годы с диаграммами состояния мне иметь дело особо-то и не доводилось. Тем не менее в те времена появилось ощущение, что что-то в этих правилах определения состава системы меня смущает и спустя год я понял, что же именно. Дело было в следующем. Очевидно, что доли компонентов системы связаны между собой соотношением
однако из такого равенства неизбежно следует, что для графического изображения множества точек, координаты которых удовлетворяют такому равенству, необходимо использовать трёхмерное пространство, потому что переменных в уравнении три, но при этом треугольник Гиббса-Розебома – это именно треугольник, то есть плоская (двумерная) фигура. Почему так? В итоге до меня дошла очень простая вещь: если переписать (3) как
то получается известное из аналитической геометрии «уравнение плоскости в отрезках», которое в общем виде записывается так:
Из этого факта как раз и следует, что для построения диаграммы состояния трёхкомпонентной системы вполне достаточно плоского изображения. А ещё любопытно здесь другое. Взгляните на рис. 4 – на нём изображён треугольник Гиббса-Розебома в «трёхмерном» представлении.
В связи с этим мне в голову уже давно закралась следующая мысль: а может создатели диаграмм состояния, когда разрабатывали способы наглядного преставления характеристик трёхкомпонентых систем, руководствовались схожими соображениями – про уравнение плоскости «в отрезках», про получающиеся при этом подобные треугольники и т. д.? Не удивлюсь, если такое действительно было опубликовано тем же самым Дж.У. Гиббсом в своих научных работах, а теперь, спустя более века и став классикой, успело подзабыться. В учебниках по физической химии, на которые я выше ссылался, и в ряде других [5, с. 422; ; 7, с. 401], сведений, подтверждающих приведённые догадки, нет – такую информацию нужно искать специально, но сначала необходимо суметь заставить себя заняться подобными поисками.
Кстати, схожая ситуация наблюдается и в отношении «правила креста» – очень легко отыскать литературу и сайты, где подробно рассказывается как решать задачи на смешение растворов с использованием этого правила, а вот материала, в котором описано откуда именно это правило берётся (то есть его математическое обоснование), мне обнаружить не удалось – пришлось восполнять этот пробел самостоятельно написанием соответствующей заметки.
Метод отталкивания локализованных электронных пар валентной оболочки центрального атома (метод Гиллеспи); дипольный момент молекулы
Материалы портала onx.distant.ru
Основные положения метода
Обозначения, используемые в методе Гиллеспи
А – центральный атом;
X – лиганд, с которым центральный атом образует химическую связь, то есть даёт связывающие электронные пары;
Е – неподелённая электронная пара;
n, m – соответственно число связывающих и неподелённых электронных пар.
Алгоритм определения строения молекул по методу Гиллеспи
Для того, чтобы определить строение молекулы методом Гиллеспи, предлагается следующий порядок действий.
(n + m) = 1/2 (Nц + Nл – z ) – π (1)
Nц – число электронов центрального атома на его внешнем электронном слое,
Nл – число электронов лигандов, участвующих в образовании связей с центральным атомом,
π – число π-связей в молекуле,
z – заряд иона (в случае определения строения молекулярного аниона).
В табл. 1. обобщаются возможные варианты использования метода Гиллеспи для определения строения различных молекул.
Таблица 1. Геометрия молекул неорганических и органических веществ.
| № | Тип молекулы | Примеры | Общее число связывающих и неподелённых электронных пар | Пространственное расположение электронных пар | Число связывающих электронных пар | Геометрия молекулы |
| 1 | AX2E0 | BeCl2, CO2 | 2 | линейное | 2 | линейная |
| 2 | AX3E0 | BF3, SO3 | 3 | правильный треугольник | 3 | правильный треугольник |
| 3 | AX2E1 | SnCl2 SO2 | 3 | правильный треугольник | 2 | угловая |
| 4 | AX4E0 | CH4, CCl4 | 4 | тетраэдр | 4 | тетраэдр |
| 5 | AX3E1 | NH3, PH3 | 4 | тетраэдр | 3 | треугольная пирамида |
| 6 | AX2E2 | H2O | 4 | тетраэдр | 2 | угловая |
| 7 | AX5E0 | PCl5 | 5 | тригональная бипирамида | 5 | тригональная бипирамида |
| 8 | AX4E1 | SF4 | 5 | тригональная бипирамида | 4 | “качели” |
| 9 | AX3E2 | ClF3 | 5 | тригональная бипирамида | 3 | “Т-образная” |
| 10 | AX2E3 | XeF2 | 5 | тригональная бипирамида | 2 | линейная |
| 11 | AX6E0 | SF6 | 6 | октаэдр | 6 | октаэдр |
| 12 | AX5E1 | ICl5 | 6 | октаэдр | 5 | квадратная пирамида |
| 13 | AX4E2 | XeF4 | 6 | октаэдр | 4 | плоская |
| 14 | A + X4E0 | NH4 + | 4 | тетраэдр | 4 | тетраэдр |
| 15 | AX4 2- E0 | SO4 2- | 4 | тетраэдр | 4 | тетраэдр |
| 16 | AX3 2- E1 | SO3 2- | 4 | тетраэдр | 3 | треугольная пирамида |
| 17 | A — X6E0 | PCl6 — | 6 | октаэдр | 6 | октаэдр |
| 18 | AX’1X»2E0 | COCl2 | 3 | правильный треугольник | 3 | правильный треугольник |
Дипольный момент молекулы
Мера полярности связи – её дипольный момент (μ) – определяется произведением:
μ = ql
где q – эффективный заряд, l – длина диполя (расстояние между двумя равными по величине и противоположными по знаку зарядами +q и –q).
Дипольный момент – это векторная величина. Понятия “дипольный момент связи” и “дипольный момент молекулы” совпадают только для двухатомных молекул. Дипольный момент сложной молекулы равен векторной сумме дипольных моментов всех связей. Дипольный момент многоатомной молекулы зависит не только от полярности отдельных связей в молекуле, но и от геометрической формы молекулы.
Рис. 1. Дипольные моменты молекул СО2 и Н2О
Примеры определения строения молекул по методу Гиллеспи
Пример 1. Молекула BF3.
n + m = (4 + 2)/2 = 3
(у олова на внешнем слое четыре электрона и два электрона дают атомы хлора; π-связи в молекуле отсутствуют).
Пример 3. Молекула XeF4.
(у атома Хе восемь электронов на внешнем электронном слое и два электрона дают атомы F; π-связи в молекуле отсутствуют).
Пример 4. Молекула SO2.
(у атома серы на внешнем электронном слое шесть электронов, четыре электрона дают два атома кислорода; в молекуле две π-связи которые вычитаются при определении n+m).
Атом серы имеет шесть валентных электронов. Из них четыре идут на образование π- и σ-связей с двумя атомами кислорода (О= S= O). В результате, у атома серы остается одна неподелённая пара электронов.
Строение карбонат-иона – плоский треугольник.
Задачи для самостоятельного решения
1. Из приведенных молекул полярными являются: