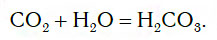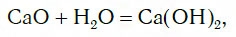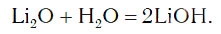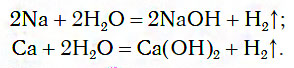С чем взаимодействует вода
Урок 28. Химические свойства воды
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.
При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).
При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):
Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам. Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах. Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
Взаимодействие с оксидами металлов
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
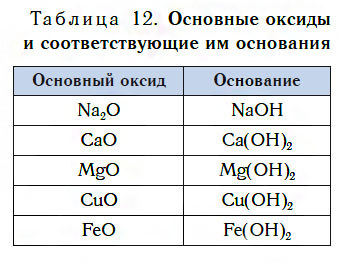
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
В этих реакциях выделяется водород и образуются растворимые в воде основания.
Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
Краткие выводы урока:
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Все химические реакции, которые необходимы для успешной сдачи ОГЭ
Правило 1.1. Взаимодействие простых веществ (металлов и неметаллов) с водой
1) Щелочные (Li-Fr) и щелочноземельные (Ca-Ra) металлы взаимодействуют с водой при комнатной температуре с образованием щелочи (растворимого основания) и выделением водорода. Например:
2) Магний также взаимодействует с водой, но при сильном нагревании и с образованием нерастворимого гидроксида:
3) Алюминий реагирует с водой, но только если убрать оксидную пленку:
4) Металлы, находящиеся в ряду активности от Zn (включительно) до Pb (включительно), взаимодействуют с парами воды (т.е. при температуре выше 100°С), при этом образуются оксиды соответствующих металлов и водород:
5) Металлы, стоящие в ряду активности правее водорода, с водой не взаимодействуют даже при нагревании.
Cu + H2O → реакция не идет.
6) Из неметаллов с водой реагируют галогены, C и Si при высоких температурах:
Правило 1.2. Взаимодействие оксидов с водой
1) Основные оксиды щелочных и щелочноземельных металлов реагируют с водой при комнатной температуре с образованием соответствующих щелочей:
2) Амфотерные оксиды не реагируют с водой и не растворяются в ней.
ZnO + H2O → реакция не идет.
3) Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот: P2O5 + 3H2O → 2H3PO4
Только в случае NO2 образуются две кислоты:
2NO2 + H2O → HNO2 + HNO3 и, как следствие, при взаимодействии с щелочами образуются две соли (нитраты и нитриты соответствующего металла):
SiO2 + H2O → реакция не идет.
Урок №31. Физические и химические свойства воды. Применение воды
ВОДА
Молекула воды состоит из атома кислорода и двух атомов водорода, присоединившихся к нему под углом 104,5°.
Угол 104,5° между связями в молекуле воды обусловливает рыхлость льда и жидкой воды и как следствие аномальную зависимость плотности от температуры. Именно поэтому крупные водоемы не промерзают до дна, что делает возможным существование в них жизни.
Физические свойства
ВОДА, ЛЁД И ПАР, соответственно жидкое, твердое и газообразное состояния химического соединения с молекулярной формулой Н 2 О.
Вода обладает исключительно большой теплоёмкостью, поэтому она медленно нагревается и медленно остывает. Благодаря этому водные бассейны регулируют температуру на нашей планете.
Химические свойства воды
Вода — весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочноземельными металлами. Вода образует соединения – кристаллогидраты.
Под действием электрического тока вода разлагается на водород и кислород:
2H 2 O электрический ток = 2H 2 ↑+ O 2 ↑
I. Взаимодействие воды с металлами
Щелочные металлы – это I(А) группа – Li, Na, K, Rb, Cs, Fr
Щелочноземельные металлы – это II(А) – Ca, Sr, Ba, Ra (Be, Mg не относятся)
Me + H 2 O = Me(OH) n + H 2 (р. замещения)
Внимание! Алюминий и магний ведут себя также.
Металлы средней активности, стоящие в ряду активности до (Н 2 ) – Be, Fe, Pb, Cr, Ni, Mn, Zn – реагируют с образованием оксида металла и водорода
Me + Н 2 О = Ме х О у + Н 2 (р. замещения)
Например, бериллий с водой образует амфотерный оксид: Be + H 2 O = BeO + H 2
3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + H 2 O ≠ нет реакции
II. Взаимодействие воды c неметаллами
Cl 2 + H 2 O = HCl + HClO
C + H 2 O = t°С = CO + H 2
Si + 2H 2 O = t°С = SiO 2 + 2H 2
III. Взаимодействие с оксидами металлов
1). Взаимодействие с основными оксидами
Реакция соединения протекает при обычных условиях, при этом образуется растворимое основание – щёлочь.
H 2 O + ОКСИД МЕТАЛЛА = Ме(ОН) n (р. соединения)
Na 2 O + H 2 O = 2NaOH
BaO + H 2 O = Ba(OH) 2
Al 2 O 3 + H 2 O ≠ нет реакции
I. Реакции, в которых вода играет роль окислителя
Эти реакции возможны только с сильными восстановителями, которые способны восстановить ионы водорода, входящие в состав молекул воды, до свободного водорода.
1) Взаимодействие с металлами
а) При обычных условиях Н2О взаимодействует только со щел. и щел.-зем. металлами:
2Na + 2Н + 2О = 2NaOH + H 0 2↑
б) При высокой температуре Н2О вступает в реакции и с некоторыми другими металлами, например:
в) Al и Zn вытесняют Н2 из воды в присутствии щелочей:
2) Взаимодействие с неметаллами, имеющими низкую ЭО
(реакции происходят в жестких условиях)
C + Н + 2О = CO + H 0 2↑ («водяной газ»)
В присутствии щелочей кремний вытесняет водород из воды:
3) Взаимодействие с гидридами металлов
NaH + Н + 2 O = NaOH + H 0 2↑
4) Взаимодействие с угарным газом и метаном
Реакции используются в промышленности для получения водорода.
II. Реакции, в которых вода играет роль восстановителя
1) Взаимодействие с фтором
2) Взаимодействие с атомарным кислородом
3) Взаимодействие с хлором
При высокой Т происходит обратимая реакция
Под действием электрического тока или высокой температуры может происходить разложение воды на водород и кислород:
Реакции гидратации
I. Гидратация ионов.
Ионы, образующиеся при диссоциации электролитов в водных растворах, присоединяют определенное число молекул воды и существуют в виде гидратированных ионов. Некоторые ионы образуют столь прочные связи с молекулами воды, что их гидраты могут существовать не только в растворе, но и в твердом состоянии. Этим объясняется образование кристаллогидратов типа CuSO4 • 5H2O, FeSO4• 7Н2O и др., а также аквакомплексов: [Cr(H2O)6]CI3, [Pt(H2O)4]Br4 и др.
II. Гидратация оксидов
III. Гидратация органических соединений, содержащих кратные связи
Реакции гидролиза
Fe 3+ + Н2O = FeOH 2+ + Н + ; (кислая среда. рН
в) по катиону и по аниону соли
II. Гидролиз карбидов металлов
III. Гидролиз силицидов, нитридов, фосфидов
IV. Гидролиз галогенов
V. Гидролиз органических соединений
Классы органических веществ
Продукты гидролиза (органические)
Альдегиды или кетоны
Галогенангидриды карбоновых кислот
Ангидриды карбоновых кислот
Сложные зфиры карбоновых кислот
Карбоновые кислоты и спирты
Глицерин и высшие карбоновые кислоты
Азотсодержащие гетероциклы, пентозы (рибоза или дезоксирибоза)
Вода и ее химические свойства
Дата публикации: 25.02.2019 2019-02-25
Статья просмотрена: 7032 раза
Библиографическое описание:
Калякин, С. Н. Вода и ее химические свойства / С. Н. Калякин, С. Л. Покутняя. — Текст : непосредственный // Юный ученый. — 2019. — № 3 (23). — С. 20-23. — URL: https://moluch.ru/young/archive/23/1404/ (дата обращения: 27.12.2021).
Понять воду, значит понять Вселенную.
Масару Эмото (1943–2014), японский исследователь
Вода — один из самых распространённых соединений на нашей планете. Именно она является главной составляющей всего живого на планете, но также вода входит в состав комет, большинства планет солнечной системы и их спутников. Без воды нет жизни: ведь жизнь на Земле появилась только тогда, когда на ней появилась вода. Вся жизнь зародилась в воде, поскольку она является естественным универсальным растворителем, а значит вода растворяет питательные вещества и обеспечивает ими клетки живых организмов. Если рассматривать показатель количества данного оксида во всех агрегатных состояниях, то его на планете около 75 % от общей массы. По примерным подсчетам ученых на планете 1.4087 млрд. км 3 воды (причем соленой воды от общего объема примерно 97 %, пресной всего 3 %).
Да и сам человек на 60–80 % (в зависимости от возраста) состоит из воды. Большая часть воды — это кровь, жидкость в выделительной системе, мускулах, мозге и других органах, а также в костях и коже.
В понятии химии вода — это H2O, то есть две молекулы водорода и одна молекула кислорода. Но это дистиллированная вода. В природе вода содержит различные примеси и очень редко встречается в чистом виде. При взаимодействии водорода с кислородом происходит выделение большого количества тепла. Это соединение очень устойчивое, молекулы которого распадаются только при температуре 1500°С.
Рис. 1 Строение атома воды и оксид в виде тетраэдра
Вода — весьма активное в химическом отношении вещество. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ, именно поэтому вода — это определяющий характер химии. Вода имеет различные физические и химические свойства, но посмотрим на воду с химической точки зрения.
Вода является неотъемлемой частью всех биохимических процессов организма, являясь растворителем, катализатором и средой. Вода способна растворять некоторые кислоты, основания и соли, представляющие ионные соединения и некоторые полярные неионные образования (простые спирты, сахара и аминокислоты). Благодаря воде сохраняется упругость и объем живой клетки, многие химические процессы организма протекают именно в водных растворах. Эти свойства дают клеткам теплопроводимость и теплоемкость, обеспечивающие терморегуляцию и защищает от температурных перепадов.
Без воды невозможен гидролиз — химическая реакция, которая сопровождает усвоение белков, жиров, углеводов, а ведь именно они являются обязательным компонентом нашей пищи, так, например, белок распадается на аминокислоты, углевод на глюкозу, жиры на глицерин. В результате этого процесса сложные органические вещества распадаются до простых веществ, которые, легко усваиваются живым организмом.
Вода является наиболее распространённым растворителем на нашей планете. По растворимости в воде вещества делятся на три группы:
1) Хорошо растворимые: (сахар (С12Н22О11), гидроксид натрия (NaOH), спирт (C2H5OH), хлороводород (HCl).
3) Практически не растворимые: (стекло, серебро (Ag), золото (Au), керосин, растительное масло).
Из этого можно сделать вывод, что растворимость вещества прежде всего зависит от природы этого вещества, а также от температуры и давления окружающей среды. Сам процесс растворения обуславливается взаимодействием частиц растворителя и растворяемого вещества.
Вода может взаимодействовать:
1) с металлами с выделением водорода:
− с активными 2Na + 2H2O → H2 + 2NaOH (бурно)
− со средней активностью до H 3Fe + 4H2O → 4H2 + Fe3O4 (только при нагревании)
− с малоактивными после H (не взаимодействуют) Cu+ H2O ≠
Достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
2) с неметаллами:
Из неметаллов с водой реагируют углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
C + H2O → H2 + CO (при сильном нагревании)
3) с оксидами неметаллов:
Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения:
4) с оксидами металлов
Некоторые оксиды металлов также могут вступать в реакции соединения с водой.
CaO+ H2O → Ca(OH)2 гидроксид кальция (гашеная известь)
Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует: ZnO, TiO2, Cr2O3, из которых изготовляют, например, стойкие к воде краски. Оксиды железа также не растворимы в воде и не реагируют с ней.
5) с газами
Как говорилось в подпункте 4 вода взаимодействует с оксидами неметаллов. В данном случае CO2 — это газ. Если струю газообразного оксида углерода (IV) CO2 направить в воду, то часть его раствориться в ней. В этом растворе произойдет химическая реакция соединения и образуется вещество — угольная кислота H2CO3. Собирая углекислый газ над водой, ученый Джозеф Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути, Пристли впервые получил напиток газированный или содовой воды. Позже ученый Торберн Бергман создал аппарат, позволяющий насыщать жидкость углекислым газом под давлением и назвав его сатуратором.
Рис. 2 Джозеф Пристли и его прибор для исследования газов.
6) Гидраты.
Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называется кристаллогидратом.
NaOH + H2O → NaOH . H2O (гидрат едкого натра)
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью удаляют водяные пары из влажного атмосферного воздуха.
7) Фотосинтез растений.
Фотосинтез — процесс, протекающий в зеленных листьях растений с использованием энергии света, при котором из углекислого газа и воды образуются органические вещества и кислород. Синтез растениями крахмала (C6H10O5)n и других подобных соединений (углеводов), происходящая с выделением кислорода:
Рис. 3. Фотосинтез растений, как химическая реакция.
8) Электролиз воды.
Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем.
Под действием электричества электрод, подключенный к отрицательному полюсу, становится катодом, а электрод, соединённый с положительным полюсом, превращается в анод. Катод и анод притягивают противоположные ионы: к катоду направляются положительно заряженные катионы, к аноду — отрицательно заряженные анионы.
Схема электролиза воды:
Вода — слабый электролит, поэтому электролиз чистой, дистиллированной воды протекает медленно или не идёт вовсе. Для ускорения процесса в воду добавляют сильный электролит, увеличивающий проводимость электрического тока, катионы которого будут иметь меньший электродный потенциал, чем H+ воды.
Минерализация — это показатель количества содержащихся в воде растворенных веществ (неорганические соли неорганические вещества). Как правило, это бикарбонаты, хлориды, сульфаты кальция, магния, калия, натрия и других веществ. Минерализацию считают в грамм на литр (г/л) или грамм на дециметр в кубе (г/дм 3 ). С точки зрения бальнеологии по степени минерализации воду классифицируют на:
− Столовую — минерализация до 1 г/л
− Лечебно-столовую — минерализация от 1 г/л до 10 г/л
− Лечебная — минерализация более 10 г/л или высокое содержание биологически активных элементов: железо, брома, йода, сероводорода, фтора и т. д., при этом общая минерализация может быть невысокой.
Свойство минерализации основано на дипольном моменте оксида водорода. Благодаря его наличию молекулы способны присоединять к себе множество других веществ ионов и удерживать их. Так формируются ассоциаты, клатраты и прочие объединения.
Жесткость воды — совокупность свойств, обусловленных содержанием в воде катионов кальция Ca 2+ и магния Mg 2+ (так называемых солей жесткости).
В жесткой воде плохо мылится мыло, которое представляет собой натриевые соли высших карбонатных кислот. Для устранения жесткости воды (ее умягчения) необходимы ионы Ca 2+ и Mg 2+ перевести в осадок. Временную карбонатную жесткость устраняют кипячение:
Ca(HCO3)2 
Постоянную жесткость кипячением устранить нельзя. Для этого добавляют в воду смесь гашенной извести Ca(OH)2 или соды Na2CO3
Са(НСО3)2 + Са(ОН)2 → 2СаСO3↓ + 2Н2O
В теории Льюиса (1923 г.) на основе электронных представлений было ещё более расширено понятие кислоты и основания. С точки зрения теории Льюиса — вода — это слабая кислота и слабое основание одновременно (амфолит). То есть можно сказать о некоторой амфотерности воды в химических свойствах.
Подводя итог вышесказанного можно сказать, что вода — это самое уникальное вещество на земле. Академик Владимир Иванович Вернадский писал: «Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы с ней сравниться по влиянию на ход основных, самых грандиозных, геологических процессов. Не только земная поверхность, но и глубокие — в масштабе биосферы — части планеты определяются, в самых существенных своих проявлениях, ее существованием и ее свойствами». Действительно, нет более важного для нас вещества на Земле, чем обыкновенная вода, и в то же время не существует другого такого же вещества, в свойствах которого было бы столько противоречий и аномалий, как в свойствах воды.