Рнк coronavirus sars cov 2 что это значит
Рнк coronavirus sars cov 2 что это значит
Исследование для выявления коронавируса SARS-CoV-2, которое позволяет с помощью метода полимеразной цепной реакции (ПЦР) определить генетический материал (РНК) вируса в образце биоматериала.
Коронавирусная инфекция, ковид.
COVID-19 PCR test, 2019-nCoV PCR, RNA [polymerase chain reaction, PCR].
Полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР).
Аналитическая чувствительность тест-системы – 5*10^2 копий (1*10^5 копий/мл).
Какой биоматериал можно использовать для исследования?
Мазок из ротоглотки и носоглотки.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Коронавирусы – это РНК-содержащие вирусы, на сегодняшний день известно 40 видов. В конце 2019 года был выявлен новый штамм коронавируса – SARS-CoV-2, который вызывает коронавирусную инфекцию COVID-19.
Коронавирусы названы в честь короноподобных шипов на поверхности вируса. У коронавируса SARS-CoV-2 выделяют два подтипа: S и L. S-подтип – более ранний, был сфокусирован в Ухани, вызывает более тяжелое течение заболевание, а L – поздний штамм, распространился по всему миру.
Вирус передается от человека человеку воздушно-капельным, воздушно-пылевым и контактным путем, через рукопожатия и поверхности предметов, на которых он может существовать определенное время. Инкубационный период – до 14 дней, в среднем симптомы появляются на 5-6-е сутки.
Коронавирус тропен к эпителиальным клеткам легких, желудка и кишечника. Поскольку чаще всего «входными воротами» инфекции служат дыхательные пути, то вирус приводит к развитию респираторных симптомов. У большинства заболевших инфекция протекает в легкой форме, носящей симптомы ОРВИ. В группе риска пожилые люди, курильщики и люди с хроническими заболеваниями. У них коронавирусная инфекция может протекать с развитием тяжелой пневмонии и респираторного дистресс-синдрома. У детей заболевание чаще всего протекает в легкой форме.
Молодые люди и дети могут переносить инфекцию бессимптомно, что способствует распространению COVID-19 среди населения.
К основным симптомам относятся:
Реже заболевание проявляется диареей, тошнотой и рвотой.
Диагностика коронавирусной инфекции проводится при помощи метода ПЦР, который позволяет выявить генетический материал вируса в организме.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Причины положительного результата:
Причины отрицательного результата:
Все пациенты, прибывшие из стран с высоким уровнем распространения COVID-19 или контактировавшие с прибывшими оттуда, а также пациенты с повышенной температурой тела и/или явными симптомами ОРВИ будут направляться для обследования согласно рекомендациям Роспотребнадзора.
Кто назначает исследование?
Инфекционист, педиатр, врач общей практики, анестезиолог-реаниматолог.
ПЦР (COVID-19), РНК коронавируса SARS-CoV-2
* обращаем Ваше внимание, что цена на Выезде на дом отличается, можно уточнить при заказе
Стоимость взятия биоматериала: 390₽
ПЦР исследование направлено на выявление РНК (генетического материала) возбудителя, вызвавшего пандемию COVID 19 – коронавируса SARS CoV-2. Является специфическим тестом, подтверждающим инфекцию COVID 19.
По распоряжению органов Роспотребнадзора при сдаче теста на ПЦР Ковид (выявление РНК коронавируса) требуется обязательное предоставление данных паспорта/ свидетельства о рождении, адреса места проживания и контактного телефона, в качестве дополнительных идентификаторов могут использоваться номер полиса ОМС и номер СНИЛС. Анонимная сдача анализа невозможна.
SARS-CoV-2 – новый тип коронавируса, высокозаразен. Источником заражения может быть заболевший человек, имеющий клинические признаки и симптомы заболевания; внешне здоровый, находящийся в инкубационном (скрытом) периоде болезни; или внешне здоровый бессимптомный носитель. Распространяется коронавирус воздушно-капельным (при кашле, разговоре), воздушно-пылевым (воздух) и контактным путём (дверные ручки, поручни и т.д). Входные ворота инфекции – слизистая оболочка носоглотки и ротоглотки, по мере прогрессирования инфекции проникает в нижние дыхательные пути и поражает ткань лёгких и мелкие сосуды. К подозрительным признакам относятся сухой кашель без насморка и отделения мокроты, нарушение обоняния и вкуса, мышечные боли, высокая температура, при продолжении инфекции – одышка, чувство нехватки воздуха и сдавления в грудной клетке. Течение заболевания варьирует от бессимптомных форм до тяжелого течения с развитием воспаления легких, дыхательной недостаточности и поражения других органов и систем.
При наличии признаков острого респираторного заболевания или при подозрении на COVID, рекомендуется вызвать участкового терапевта, неотложную или скорую помощь в зависимости от состояния.
В каких случаях назначается исследование?
Что означают результаты теста?
Формат выдачи результата – качественный.
В норме ответ «не обнаружено».
Результат «обнаружено» означает наличие возбудителя (выявление РНК коронавируса) и является подтверждающим исследованием для постановки диагноза COVID. Независимо от того, имеются признаки заболевания или нет, пациент обязан обратиться к врачу и соблюдать карантин 2 недели до получения отрицательного результата следующего ПЦР исследования. Все данные пациентов, имеющих положительные результаты ПЦР- тестов, передаются в органы Роспотребнадзора.
Как подготовиться к анализу?
Материал для исследования – мазок из носоглотки и ротоглотки. Материал для исследования можно сдать в течение дня, при этом нужно воздержаться от использования местных препаратов и приёма пищи в течение 2ух часов до исследования. Пить воду можно. Анализ можно сдать только при предоставлении всех паспортных данных, анонимная сдача невозможна. При использовании набора для самостоятельного взятия материал в медицинских офисах лаборатории принимается до отъезда курьера. Уточнить время приема биоматериала можно в карточке теста на сайте, во вкладке – «ограничение».
«Нам повезло. SARS-CoV-2 — это вирус, с которым удобно работать»
Коронавирус будет продолжать циркулировать и в следующем году, а ситуация в мае 2022 года может ничем не отличаться от нынешней, считает ведущий научный сотрудник Федерального научного центра исследований и разработки иммунобиологических препаратов им. М.П. Чумакова РАН Любовь Козловская. Эксперт полагает, что чем раньше люди смирятся с существованием новой сезонной болезни, тем лучше. Также Любовь Козловская рассказала «Известиям» о том, почему «КовиВак» вызывает меньше побочных реакций, чем другие вакцины, быстро ли мутирует коронавирус и чем положенный в основу «чумаковской вакцины» промышленный штамм AYDAR-1 отличается от первоначального уханьского.
— Любовь, именно вы занимались выделением SARS-CoV-2 для того, чтобы получить промышленный штамм и на его основе создать инкативированную вакцину «КовиВак». Это было трудно?
— Нам повезло. SARS-CoV-2 — это вирус, с которым удобно работать. Он легко растет в культуре клеток. Далеко не все вирусы это делают, обычно приходится долго подбирать клетки, среду, температуру… Мы буквально из первой партии мазков смогли выделить достаточное количество изолятов (вариантов вируса, размноженных в культуре клеток в лабораторных условиях. — «Известия»), чтобы дальше с ними работать. И потом только накапливали штаммы, которые просто оценивали: «Может быть этот, а может вон тот лучше».
— Коронавирусы, которые берутся, допустим, от соседей по палате, сильно отличаются? Или это одна и та же генетическая последовательность?
— В основном нет. Это очень и очень похожие последовательности, иногда отличающиеся на один нуклеотид, иногда совсем одинаковые. Это не всегда означает, что люди друг друга перезаражали. Обычно у нормальных среднестатистических РНК-вирусов так не бывает, они могут отличаться довольно заметно у двух людей рядом. Здесь же наоборот. Коронавирусы ужасающе похожи. Если брать вирус, выделенный в начале пандемии в Ухане, то варианты, которые у нас есть сейчас, отличаются от него всего на 30 нуклеотидных позиций на 30-тысячный геном.
— Чем отличается вариант «Ухань-1», который в научных статьях называют коронавирусом начала пандемии, от AYDAR-1 — штамма, который лег в основу «КовиВака»?
— За первые 3–4 месяца, когда вирус пришел в Европу, он уже был не таким, как «Ухань-1». Патоген получил основные семь нуклеотидных мутаций, включая самую распространенную на сегодняшний день мутацию в спайке — D614G.
AYDAR-1 содержит ровно эти семь мутаций. У него есть и D614G, это как минимум на одну меньше, чем у всяких британских штаммов, американских, южноафриканских и прочих.
— Сколько у вас уже «Айдаров»?
— У нас не очень много штаммов, так как штамм — это закрепленный в клеточной культуре или на животных вариант вируса, который имеет строго определенные свойства. А вот изолятов у нас много. Изолят — это, по сути, мазок, взятый от больного человека, которым мы заразили клетки, а потом собрали вирусы в размноженном виде в культуральной жидкости. Это еще не штамм, он может меняться, приобретать замены, поскольку переходит из человеческого организма в культуру клеток. Изоляты носят просто порядковый номер, а вот штамм уже носит имя. В коллекции Института Чумакова, может, пара десятков штаммов, а вот изолятов — тысячи.
— Зачем нужно много штаммов?
— Мы вакцинируем одним штаммом, а проверяем, заразив животных другим штаммом. Это некий хороший тон. Когда вы делаете вакцину на одном штамме и проверяете на антитела к нему же, то очевидно, что они будут. Мы же хотим, чтобы препарат вообще против вируса работал и это не были специфичные только к этому штамму антитела.
— Чтобы вакцина потом работала даже при встрече с британским, южноафриканским и еще неизвестными будущими вариантами вируса?
— Да, это наша задача. Когда к нам приходит другой вирус, у него часть аминокислотной последовательности отличается. Соответственно, часть выработанных вакциной антител на него сядет, а часть — нет. Но надо понимать, что часть на него всё равно сядет. И относиться спокойно к тому, что в течение пандемии у SARS-CoV-2 появляются мутации.
— Вы смотрите все научные статьи, которые выходят по мутациям?
— Да, насколько успеваю.
— Откуда вы узнаете о новых мутациях?
— Из прессы, конечно. Я не успеваю проснуться, как мне уже сообщают о том, что в Индии всё ужасно.
— И дальше вы идете смотреть научную статью про индийский штамм? Смотрите базу геномов?
— Не иду, я просто жду, что будет дальше. Обычно пресса сообщает значительно быстрее, чем если я буду тратить время на просмотр сотни статей. У меня есть автоматическое оповещение о том, что выходит какое-то количество статей по SARS, оно мне присылает в день все ссылки, которые вышли в PubMed. Там у меня стоит в день ограничение — 370 (показывать не больше 370 статей в день. — «Известия»). Я успеваю посмотреть первые 100 заголовков, из которых 99 мне не нужны. Сейчас пресса, спасибо, следит за основными статьями Cell, Science, Nature, поэтому я жду, что мне расскажут, а уже потом иду читать исходную ссылку.
— Допустим, из прессы вы поняли, что индийский штамм вам интересен. Вы идете в международную базу смотреть, что это такое?
— Честно говоря, сегодня это бесполезно. В GISAID — базе, которая стала основной по коронавирусным последовательностям, их уже 1,5 млн. Каждый день туда добавляется еще несколько тысяч. Я даже с ними физически работать не могу, у меня компьютер виснет. Это уже такое количество последовательностей, что их даже выровнять нельзя, не то что посмотреть филогеографию, как они распространялись, кто от кого идет, где и сколько замен. Спасибо, есть Nextstrain (в переводе «следующий штамм». — «Известия») — это проект энтузиастов, который позволяет посмотреть, откуда происходит штамм. Раньше можно было, если ты выкладываешь последовательность, на следующий день посмотреть дерево и его корни, но они могут обработать в этом алгоритме за сутки не более 3,5–4,5 тыс. записей.
— Действительно ли нужно следить за каждым меняющимся нуклеотидом SARS—CoV-2?
— Конечно, нет. Когда вы нашли какую-то мутацию, вам еще надо доказать, что она действительно имеет какое-то значение. Например, что вирус стал действительно лучше распространяться. Однако убедиться в том, что вирус лучше распространяется именно из-за той или иной мутации, довольно трудно. Допустим, вы меряете показатель распространения патогена от человека к человеку и видите, что его трансмиссивность (передаваемость) резко возросла. Но она же могла вырасти и по какой-то другой причине. Возможно, то, что происходит сейчас в Индии, не связано со свойствами штамма. А связано с тем, что стало, например, теплее или улучшилась диагностика.
— Так получается, сравнивать мутации бесполезно?
— В них, наверное, надо разбираться. Например, смотреть именно значимые мутации: не нуклеотидные, а аминокислотные. С другой стороны, я абсолютно уверена, что есть локальные варианты SARS-CoV-2, например, в Африке, про которые мы никогда ничего не узнаем. Их там просто не секвенируют. А они, возможно, значительно вирулентнее (заразнее) либо значительно лучше распространяются, чем то, с чем мы имеем дело. Если поискать, возможно, и у нас в России есть какой-нибудь ямало-ненецкий штамм, который ужасен, но мы о нем пока ничего не знаем. А в базе лежат британские — 420 тыс., так как эта страна отсеквенировала нечеловеческое количество последовательностей.
Ведущий научный сотрудник Центра им. М.П. Чумакова Любовь Козловская
— SARS—CoV-2 мутирует не так, как остальные РНК-вирусы?
— По-другому. У SARS-CoV-2 часто мутация отбирается достаточно случайно: она появляется, а дальше из-за высокой точности полимеразы остается. Если она нелетальная, вирус с этой мутацией может спокойно жить, как жил.
— А обычно как бывает у РНК-вирусов?
— Обычно очень быстро развивается большое количество мутаций. У полиовирусов за год, думаю, 1–1,5% генома мутирует. В случае «короны» это было бы 3 тыс. нуклеотидов. А на сегодняшний день это примерно 30–50 мутаций. А ведь надо понимать, что у SARS-CoV-2 миллиарды передач, так как болеют привитые, переболевшие. Болеют легко, но они все-таки могут инфицироваться заново. Соответственно, никто в этой цепочке не исключен.
— Раз вирус так медленно мутирует, «КовиВак» будет еще долго актуален?
— Некоторые говорят, что «КовиВак» безопаснее «Спутника V». Это действительно так?
— Они обе безопасны, но «КовиВак» вызывает меньше побочных эффектов после вакцинации. «КовиВак» — это вакцина на платформе, которую удобно использовать для рутинной иммунизации, когда вы просто прививаете всех и не задумываетесь над этим. Вам, в общем, безразличны хронические заболевания. А «Спутник V» создан как вакцина быстрого реагирования, она проникает в клетки и вызывает выработку интерферона, что приводит к повышению температуры. Сами разработчики говорят: «Спутник» — это вакцина «первого эшелона». Препарат для медицинских работников, которые пойдут работать в «красную зону», для ликвидаторов пандемии. А дальше нужно уже разрабатывать вакцину, которую можно было бы применять рутинно.
— Что вы думаете по поводу третьей, четвертой волн COVID-19 в России?
— Я считаю, что коронавирус станет сезонным. У нас будет спад летом, и в октябре мы опять «накроемся». Если мы не привьем всех единомоментно, как в Израиле, Сан-Марино и Чили, значимого эффекта от вакцинации видно не будет. Такая сезонность всегда наблюдается именно в странах с умеренным климатом. И я не знаю, почему сезонные инфекции — дело загадочное. Например, до сих пор ученые не могут доходчиво объяснить, почему нет гриппа летом. Ведь, по идее, он воздушно-капельный, и ему всё равно, холодно или тепло.
— Что будет через год? В мае 2022-го?
— Думаю, всё будет точно так же. Я боялась признаться себе в этом в 2020 году. И я боюсь признаться себе в этом сейчас. У вакцинированных COVID-19 будет проходить как сезонная «корона» — небольшая простуда. У кого-то он будет вызывать пневмонию. Вирус будет продолжать циркулировать. И нам надо научиться жить с этим.
Коронавирус, РНК (SARS-CoV-2, ПЦР) мазок, кач., Roche в Москве
Качественное определение РНК бета-коронавируса SARS-CoV-2 (возбудителя COVID-19) в соскобе клеток ротоглотки методом ПЦР в режиме реального времени.
Приём и исследование биоматериала
Когда нужно сдавать анализ Коронавирус, РНК (SARS-CoV-2, ПЦР) мазок, кач., Roche?
Диагностика коронавирусной инфекции SARS-COV-2 (COVID-19).
Подробное описание исследования
Для проведения исследования используется сверхчувствительная тест-система производства Roche Molecular Systems, Inc. с аналитической чувствительностью 1х10*1 копий РНК коронавируса в миллилитре биологического материала.
SARS-CoV-2 – это РНК-содержащий бета-коронавирус семейства Coronaviridae, который был открыт в конце 2019 года в Китае. Он способен вызвать у человека острое респираторное инфекционное заболевание COVID-19 (COronaVIrus Disease 2019).
Как правило, инфекционный процесс начинается после проникновения вируса в эпителиальные клетки, выстилающие слизистые оболочки верхних дыхательные путей. В зараженных клетках начинается активная репликация вируса – многократное увеличение числа копий вирусных частиц, или вирионов. Новые вирионы выходят из пораженных клеток и заражают все большее количество здоровых клеток уже не только верхних, но и нижних дыхательных путей. В том числе возможно поражение альвеолярных клеток II типа, что определяет развитие пневмонии.
Вирионы SARS-CoV-2 способны проникать в клетки, на поверхности которых присутствует мембранный белок ангиотензинпревращающий фермент II типа (АПФ2, ACE2). Для вируса АПФ2 служит рецептором, с которым связываются гликопротеиновые «шипы» (в состав которых входит Spike- или S-белок), расположенные на поверхности вирусных частиц. Рецепторы АПФ2 представлены на оболочках клеток органов дыхательной и центральной нервной системы, пищевода, подвздошной кишки, почек, мочевого пузыря, сердца. Новый коронавирус способен поражать клетки головного мозга, с чем связывают полную потерю обоняния на ранней стадии заболевания у некоторых пациентов. По некоторым данным вирус также способен проникать в клетки, на мембране которых представлен белок CD147.
Применение полностью автоматизированной системы cobas 6800 позволяет обнаружить генетический материал – коронавирусную РНК – в короткий срок и не позднее 12 часов представить пациенту результат.
Инфекция SARS-CoV-2 может протекать бессимптомно (до 50% случаев), в легкой и в тяжелой формах. В последнем случае возможно развитие острого респираторного синдрома (Severe Acute Respiratory Syndrome, SARS) на фоне двусторонней пневмонии. Инкубационный период длится 2–14 суток (чаще 5–7 суток). После чего у пациента появляются симптомы острой респираторной вирусной инфекции (ОРВИ).
Все инфицированные коронавирусом, даже те, у кого инфекция протекает в стёртой или в бессимптомной форме, являются источником инфекции уже в первые дни после заражения. Так как они выделяют вирусные частицы в окружающую среду с выдыхаемым воздухом, при разговоре, кашле, чихании. Вирусовыделение в среднем продолжается около 20 суток, однако в отдельных случаях может продолжаться дольше месяца. Инфицированные могут выделять вирус с мочой и калом даже после полного исчезновения симптомов респираторного заболевания.
Важно помнить, что патогенез новой коронавирусной инфекции пока недостаточно изучен. И даже у пациентов, у которых инфекция протекает в лёгкой или стёртой формах возможно внезапное развитие острого респираторного синдрома на фоне пневмонии.
Особенности и преимущества методики
Тест-система: «Качественный тест для использования в системах cobas® 6800/8800» производства компании Roche Molecular Systems, Inc.
Формат представления результатов, единицы измерения.
Автоматизированная система для ПЦР-диагностики cobas 6800.
Использованная литература
Подготовка к исследованию
ПЦР-анализ нужно сдавать через 3 часа после еды. Также в течение 3 часов нельзя чистить зубы, полоскать рот и пить, курить, жевать жвачку.
Противопоказания и ограничения
Абсолютных противопоказаний нет
Интерпретация результата
«РНК обнаружена»: в анализируемом образце биологического материала найден фрагмент РНК, специфичный для коронавируса SARS-CoV-2.
«РНК не обнаружена»: в анализируемом образце биологического материала не найдено фрагментов РНК, специфичных для коронавируса SARS-CoV-2, или концентрация возбудителя в образце ниже границы чувствительности теста.
Референсные значения
Аналитические показатели
Аналитическая чувствительность – до 1х10*1 копий/мл.
Исследование происхождения SARS-CoV-2
Со времен появления первых сообщений о новом виде пневмонии (COVID-19) в городе Ухань, провинции Хубэй, Китай, ведутся серьезные дискуссии о теории происхождении возбудителя — вируса SARS-CoV-2 (также называемого HCoV-19). Инфекции, вызванные SARS-CoV-2, в настоящее время широко распространены, и по состоянию на 11 марта 2020 года было подтверждено 121 564 случая в более чем 110 странах, при этом 4373 случая заболевания оказались смертельными.
SARS-CoV-2 является седьмым коронавирусом, который достоверно вызывает какие-либо заболевания у человека. SARS-CoV, MERSCoV и SARS-CoV-2 ответственны за тяжелые респираторные проявления заболевания, тогда как HKU1, NL63, OC43 и 229E связаны с легкими симптомами. Здесь мы рассмотрим известные данные исследований, которые позволят сделать выводы о происхождении SARS-CoV-2 из сравнительного анализа геномных данных. Мы предлагаем обзор отличительных особенностей генома SARS-CoV-2 и обсуждаем сценарии, при которых данные особенности могли возникнуть. Наши анализы ясно показывают, что SARS-CoV-2 не является искусственной лабораторной конструкцией или целенаправленно управляемым вирусом.
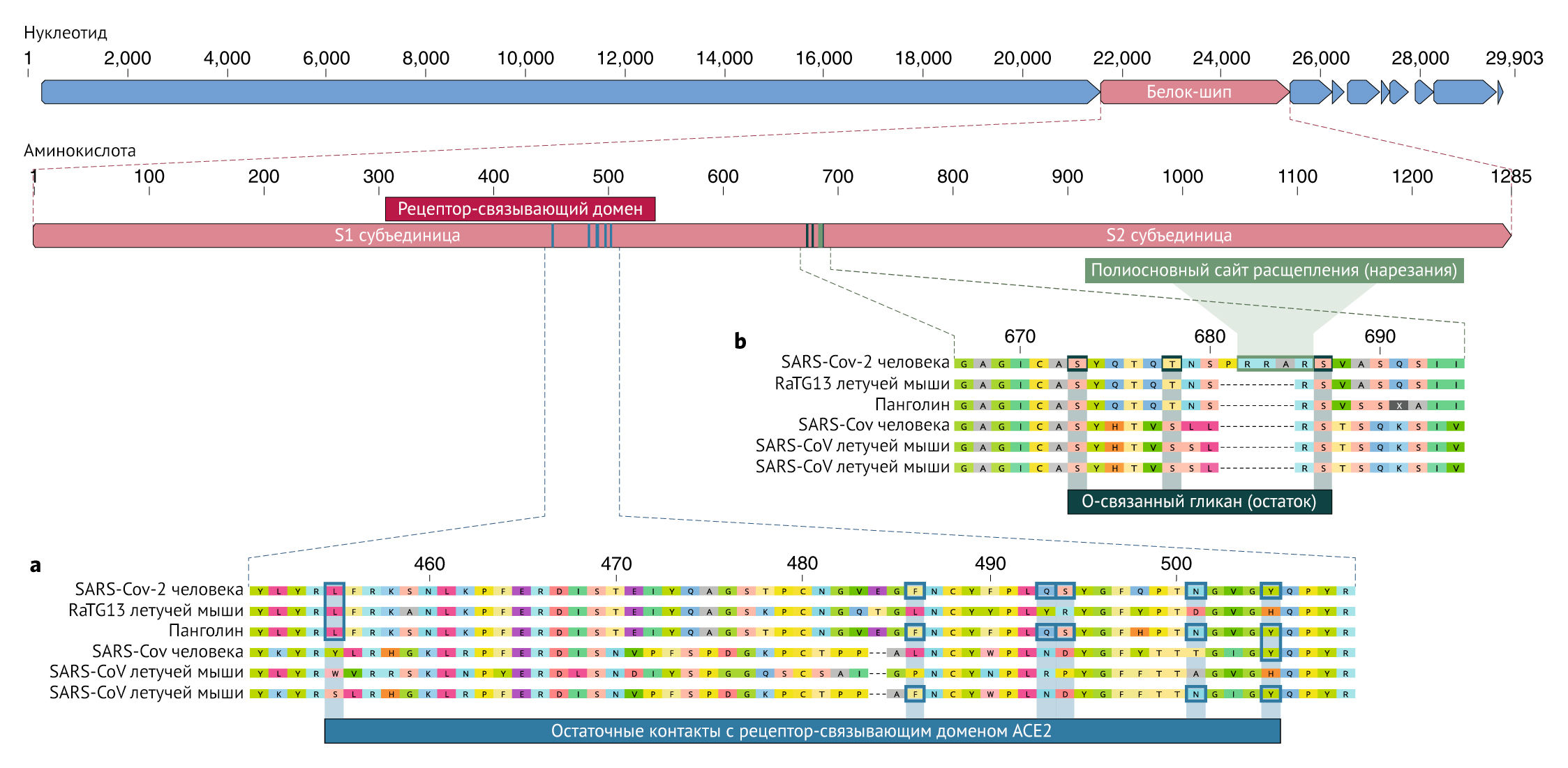
Примечательные особенности генома SARS-CoV-2
Наше сравнение альфа- и бета-коронавирусов выявляет две заметные геномные особенности SARS-CoV-2:
Мутации в рецептор-связывающем домене SARS-CoV-2
Рецептор-связывающий домен (RBD) в белке шипа является наиболее вариабельной частью генома коронавируса. Было показано, что шесть аминокислот RBD являются критическими для связывания с рецепторами ACE2 и для определения диапазона хозяев для различных SARS-CoV-подобных вирусов с координатами, основанными на SARS-CoV, — это Y442, L472, N479, D480, T487 и Y4911, которые соответствуют L455, F486, Q493, S494, N501 и Y505 в SARS-CoV-27. Пять из этих шести остатков различаются между SARSCoV-2 и SARS-CoV (рис. 1а). На основании структурных исследований и биохимических экспериментов SARS-CoV-2, по-видимому, имеет RBD, который обладает высоким сродством к ACE2 у человека, хорьков, кошек и других видов с высокой гомологией рецепторов.
Хотя приведенный выше анализ предполагает, что SARS-CoV-2 может связывать человеческий ACE2 с более высокой аффинностью, вычислительный анализ предсказывает, что его взаимодействие с рецепторами сложно назвать идеальным, и что последовательность RBD отличается от показанной в SARS-CoV, чтобы быть более «удобной» для связывания с рецептором. Таким образом, высокоаффинное связывание белка шипа SARS-CoV-2 с человеческим ACE2, скорее всего, является результатом естественного отбора на человеческом или подобном человеку рецептору ACE2. Это убедительное доказательство того, что SARS-CoV-2 не является продуктом целенаправленных манипуляций.
Сайт расщепления многоосновного фурина и О-связанные гликаны
Второй примечательной особенностью SARS-CoV-2 является многоосновный сайт расщепления (RRAR) на стыке S1 и S2, двух субъединиц шипа (Рис. 1b). Он позволяет эффективно расщепляться фурином и другими протеазами и играет роль в повышении вирулентности и наличие широкого диапазона выбора организмов-хозяев. Кроме того, ведущий пролин также вставлен в этот сайт в SARS-CoV-2. Таким образом, вставленная последовательность является PRRA (Рис. 1b). Предполагается, что поворот, созданный пролином, приведет к добавлению O-связанных гликанов к S673, T678 и S686, которые фланкируют сайт расщепления и являются уникальными именно для SARS-CoV-2 (Рис. 1b). Подобные сайты многоосновного расщепления не наблюдались ни в каких родственных «бета-коронавирусах линии В», хотя другие бета-коронавирусы человека, включая HKU1 (линия А), имеют эти сайты и предсказывают О-связанные гликаны. Учитывая уровень генетической изменчивости в шипе, вероятно, SARS-CoV-2-подобные вирусы с частичными или полными многоосновными сайтами расщепления будут позже обнаружены и у других видов. Функциональные последствия многоосновного сайта расщепления в SARS CoV-2 неизвестны, и будет важно определить его влияние на трансмиссивность и патогенез заболевания на животных моделях.
Эксперименты с SARS-CoV показали, что вставка сайта расщепления фурином в месте соединения S1-S2 усиливает клеточное слияние, не влияя на уровень проникновения вируса. Кроме того, эффективное расщепление шипа MERS-CoV позволяет MERS, подобным коронавирусам от летучих мышей, инфицировать и клетки человека. В случае вирусов птичьего гриппа быстрая репликация и передача в очень плотных популяциях кур стала результатом приобретения многоосновных сайтов расщепления в белке гемагглютинином (HA), который выполняет функцию, аналогичную функции белка шипа коронавируса. Приобретение многоосновных сайтов расщепления в HA путем вставки или рекомбинации превращает вирусы птичьего гриппа с низкой патогенностью в высокопатогенные формы. Получение многоосновных сайтов расщепления HA также наблюдалось после повторного пассажа в клеточной культуре или через животных. Функция О-связанных гликанов в новом коронавирусе пока неясна, но они могут создавать «муциноподобный домен», который экранирует эпитопы или ключевые остатки белка-шипа SARS-CoV-2. Некоторые вирусы используют муциноподобные домены в качестве щитов гликана, связанных с ускользанием от иммунного ответа. Хотя наличие О-связанного гликозилирования в коронавирусах является лабораторно достоверным фактом, необходимы экспериментальные исследования, чтобы определить, используются ли эти сайты в SARS-CoV-2.
Теории происхождения SARS-CoV-2
Маловероятно, что SARS-CoV-2 появился в результате лабораторных манипуляций с неким родственным SARS-CoV-подобным коронавирусом. Как отмечено выше, RBD SARS-CoV-2 оптимизирован для связывания с человеческим ACE2 с помощью естественного отбора, то есть механизма, отличного от ранее предсказанного. Кроме того, если бы была проведена генетическая манипуляция, вероятно, была бы использована одна из нескольких обратных генетических систем, доступных для бета-коронавирусов. Тем не менее, генетические данные неопровержимо показывают, что SARSCoV-2 не получен из каких-либо ранее использованных вирусных магистралей. Вместо этого мы предлагаем два сценария, которые могут правдоподобно объяснить происхождение SARS-CoV-2:
Сценарий 1:
Естественный отбор у животного-хозяина перед зоонозным переносом
Так как многие ранние случаи COVID-19 были связаны с рынком Хуанань города Ухань, Китай, возможно, что источник инфекции в виде животных присутствовал именно в этом месте. Учитывая сходство SARSCoV-2 с SARS-CoV-подобными коронавирусами летучих мышей, вполне вероятно, что летучие мыши служат резервуарными хозяевами для своего предшественника. Хотя RaTG13, отобранный у летучей мыши Rhinolophus affinis, примерно на 96% идентичен SARS-CoV-2, его шип расходится в RBD, что позволяет предположить, что он не может эффективно связываться с ACE27 человека (Pис. 1a).
Малайские панголины (Manis javanica), незаконно ввезенные в провинцию Гуандун, переносили коронавирусы, похожие на SARSCoV-2. Хотя вирус летучей мыши RaTG13 остается наиболее близким к SARS-CoV-2 по характеру своего генома, некоторые коронавирусы панголина демонстрируют сильное сходство с SARS-CoV-2 в RBD, включая все шесть ключевых сайтов RBD (рис. 1). Это ясно показывает, что связывающий белок SARS-CoV-2, оптимизированный для связывания с человеческим ACE2, является результатом естественного отбора. Ни у бета-коронавирусов летучих мышей, ни у бета-коронавирусов панголина, выделенных и изученных до настоящего времени, нет многоосновных сайтов расщепления. Хотя не было выявлено ни одного коронавируса животных, который был бы достаточно похожим, чтобы быть прямым предшественником SARS-CoV-2. Разнообразие коронавирусов у летучих мышей и других видов подвергается многочисленным исследованиям. Как инсерции, так и делеции могут происходить вблизи S1-S2 соединения коронавирусов, что показывает, что сайт многоосновного расщепления может возникать в результате естественного эволюционного процесса. Для того, чтобы вирус-предшественник приобрел как сайт многоосновного расщепления, так и мутации в связывающем белке, подходящем для связывания с человеческим АСЕ2, животному-хозяину, вероятно, потребуется высокая плотность популяции (чтобы обеспечить эффективный естественный отбор для проведения) и кодирование АСЕ2 гена, похожего на человеческий ортолог.
Сценарий 2:
Естественный отбор, происходящий в организме человека после зоонозного переноса
Вполне возможно, что предок SARS-CoV-2 попал в организм человека, приобретя геномные характеристики, описанные выше, путем адаптации во время передачи от человека к человеку. После того, как эти изменения были получены, они позволили пандемии развиться и создали достаточно большое количество прецедентов, чтобы запустить систему наблюдения, которая и обнаружила новый вирус. Все секвенированные до настоящего времени геномы SARS-CoV-2 имеют генетические признаки, описанные выше, и, таким образом, происходят от общего предка, который также обладал данными признаками. Присутствие в панголинах RBD, очень похожего на SARS-CoV-2, позволяет сделать вывод, что это также было возможно в вирусе, который стал распространяться и на людей. Оценки времени происхождения последнего общего предка SARS-CoV-2, сделанные с использованием текущих данных о вирусе, указывают на появление возбудителя в конце ноября 2019 года – начале декабря 2019 года, что согласуется с самыми ранними ретроспективно подтвержденными случаями. Следовательно, этот сценарий предполагает период нераспознанной передачи у человека между начальным зоонозным событием и приобретением многоосновного сайта расщепления. По сути, эта ситуация характерна для MERS-CoV, для которой все случаи заболевания людей являются результатом повторного распространения вируса с верблюдов-дромадеров, приводящих к спорадическим инфекциям или коротким цепям передачи, которые в конечном итоге проходят без адаптации к дальнейшей устойчивой передаче. Исследования полученных от человека образцов вируса могут дать информацию о том, как именно произошло его распространение и эволюция. Ретроспективные серологические исследования также могут быть информативными, поэтому было проведено несколько подобных исследований, показывающих низкую активность SARSCoV-подобных коронавирусов в некоторых районах Китая. Однако эти исследования не смогли критически ответить на вопрос, были ли воздействия вызваны предшествующими инфекциями SARS-CoV, SARS-CoV-2 или другими SARSCoV-подобными коронавирусами. Дальнейшие серологические исследования должны проводиться для определения степени предшествующего воздействия SARS-CoV-2 на человека.
Сценарий 3:
Мутации в вирусе возникли в результате естественного отбора во время переноса
Фундаментальные исследования, связанные с пассажем SARS-CoV-подобных коронавирусов летучих мышей в клеточных культурах и/или на животных моделях, ведутся в течение многих лет в лабораториях уровня 2 по биобезопасности во всем мире, и имеются документально подтвержденные случаи лабораторных утечек SARS-CoV. Поэтому мы должны изучить возможность непреднамеренного лабораторного высвобождения SARS-CoV-2. Теоретически, возможно, что SARS-CoV-2 приобрел мутации RBD (Рис. 1a) во время адаптации к пассажу в культуре клеток, как это наблюдалось ранее в исследованиях SARS-CoV. Однако обнаружение SARS CoV-подобных коронавирусов у панголинов с почти идентичными RBD обеспечивает гораздо более логичное объяснение того, как SARS-CoV-2 приобретал их посредством рекомбинации или мутации. Приобретение как многоосновного сайта расщепления, так и O-связанных гликанов также противоречит сценариям, основанным на исследованиях в культуре клеток. Новые многоосновные сайты расщепления наблюдались только после длительного прохождения вируса птичьего гриппа с низкой патогенностью in vitro или in vivo. Кроме того, гипотетическая генерация SARS-CoV-2 путем клеточной культуры или пассажа у животных потребовала бы предварительного выделения вируса-предшественника с очень высоким генетическим сходством, которое пока не было описано. Последующее образование многоосновного сайта расщепления потребовало бы повторного пассажа в клеточной культуре или у животных с рецепторами ACE2, сходными с таковыми у людей, но такое исследование также ранее не было проведено. Наконец, генерация О-связанных гликанов также вряд ли произошла из-за пассажа в клеточной культуре, поскольку такие особенности предполагают участие иммунной системы, что невозможно в условиях клеточной культуры.
Заключение и выводы
В разгар глобальной чрезвычайной ситуации в области общественного здравоохранения разумно задаться вопросом о причинах возникновения пандемии. Детальное понимание того, как вирус животных широким шагом перешел через границы видов для столь активного заражения людей, поможет предотвратить будущие случаи зоонозного переноса. Например, если SARS-CoV-2 предварительно адаптирован к другим видам животных, то существует риск его повторного появления. Напротив, если адаптивный процесс произошел у людей, то даже если происходят повторные зоонозные переносы, они вряд ли начнут развиваться без той же серии мутаций. Кроме того, выявление ближайших родственников вируса SARS-CoV-2, циркулирующего у животных, будет в значительной степени способствовать изучению морфологии вируса, вирулентности и разработки тактики эффективной терапии. Действительно, наличие последовательности RaTG13 у летучих мышей помогло выявить ключевые мутации RBD и сайт многоосновного расщепления.
Особенности генома нового коронавируса, описанные в данном исследовании, могут частично объяснить вирулентность и контагиозность SARS-CoV-2 у людей. Хотя данные показывают, что SARSCoV-2 не является целенаправленно управляемым вирусом, в настоящее время невозможно доказать или опровергнуть другие теории его происхождения, описанные здесь. Однако поскольку мы наблюдали все заметные признаки SARS-CoV-2, включая оптимизированный RBD и многоосновный сайт расщепления, в связанных коронавирусах в природе, мы не считаем, что какой-либо искусственный лабораторный сценарий правдоподобен. Большее количество исследований может изменить баланс данных в пользу одной гипотезы по отношению к другой. Получение родственных вирусных последовательностей из животных источников было бы наиболее точным способом выявления вирусного происхождения. Например, будущее наблюдение за промежуточным или полностью сформированным многоосновным сайтом расщепления у вируса, подобного SARS-CoV-2 у животных, могло бы еще больше подкрепить гипотезы естественного отбора. Было бы также полезно получить больше генетических и морфофункциональных данных о SARSCoV-2, включая исследования на животных моделях. Идентификация потенциального промежуточного хозяина SARS-CoV-2, а также определение последовательности вируса в очень ранних случаях были бы весьма информативными. Независимо от точных механизмов, с помощью которых SARSCoV-2 возник в результате естественного отбора, постоянное наблюдение за пневмонией у людей и других животных, несомненно, имеет огромное значение.