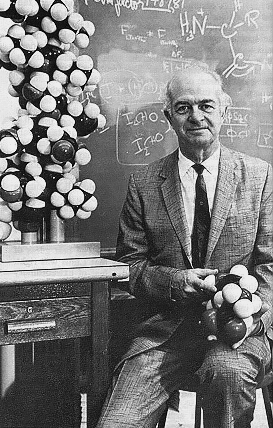Рисунок что изучает биология
Биология – наука о живой природе

Всего получено оценок: 4038.
Всего получено оценок: 4038.
Совокупность наук о живой природе называют биологией. Узнать подробнее, что изучает данная дисциплина, расширить свои знания и повторить пройденный материал в 5 классе поможет данная статья.
Биология – наука о живой природе
Всё живое на нашей планете объединяет живая природа, изучением которой и занимается наука биология.
Определение «Биология – наука о живой природе» зародилось ещё во времена античности. В переводе с греческого языка биос – это жизнь, а логос – учение.
Понятие «биология» включает в себя не одну, а целую совокупность наук, которые изучают органический мир планеты. К системе биологических дисциплин относятся:
Все живые организмы на планете условно поделены на царства. Их в природе четыре:
Отдельным царством считаются вирусы, так как они не имеют клеточного строения и живут внутри живой клетки.
которые читают вместе с этой
Человеческий организм относится к царству животных, так как функционирование систем органов и клеток человека схоже с животными.
Условия жизни на Земле
Живые организмы обитают на планете повсеместно (вода, воздух, почва). Оболочку Земли, в которой обитает органический мир, называют биосферой.
Условия, необходимые для нормального функционирования всего живого на планете:
Значение биологии
Знание биологии лежит в основе медицины и сельского хозяйства. А именно:
Что мы узнали?
Биология включает в себя знания целой системы наук. Их изучение поможет не только узнать строение и особенности жизнедеятельности организмов, но и сохранить чистой окружающую среду.
12 методов в картинках: структурная биология
Авторы
Редакторы
Науки о жизни идут по пути от крупного к мелкому. Совсем недавно биология описывала исключительно внешние черты животных, растений, бактерий. Молекулярная биология изучает живые организмы на уровне взаимодействий отдельных молекул. Биология структурная — исследует процессы в клетках на уровне атомов. Если хотите узнать, как «увидеть» отдельные атомы, как работает и «живет» структурная биология и какие использует приборы, вам сюда!
12 биологических методов в картинках
Генеральный партнер цикла — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Одна из главных миссий «Биомолекулы» — докопаться до самых корней. Мы не просто рассказываем, какие новые факты обнаружили исследователи — мы говорим о том, как они их обнаружили, стараемся объяснить принципы биологических методик. Как вытащить ген из одного организма и вставить в другой? Как проследить в огромной клетке за судьбой нескольких крошечных молекул? Как возбудить одну крохотную группу нейронов в огромном мозге?
И вот мы решили рассказать о лабораторных методах более системно, собрать воедино в одной рубрике самые главные, самые современные биологические методики. Чтоб было интереснее и нагляднее, мы густо проиллюстрировали статьи и даже кое-где добавили анимации. Мы хотим, чтобы статьи новой рубрики были интересны и понятны даже случайному прохожему. И с другой стороны — чтобы они были так подробны, что даже профессионал мог бы обнаружить в них что-то новое. Мы собрали методики в 12 больших групп и собираемся сделать на их основе биометодический календарь. Ждите обновлений!
Зачем нужна структурная биология?
Как известно, биология — это наука о жизни. Появилась она в самом начале XIX века и первые сто лет своего существования была сугубо описательной. Главной задачей биологии в то время считали найти и охарактеризовать как можно большее количество видов различных живых организмов, чуть позже — выявить родственные связи между ними. Со временем и с развитием других областей науки из биологии выделились несколько ветвей с приставкой «молекулярный»: молекулярная генетика, молекулярные биология и биохимия — науки, изучающие живое на уровне отдельных молекул, а не по внешнему виду организма или взаиморасположению его внутренних органов. Наконец, совсем недавно (в 50-х годах прошлого века) появилась такая область знания, как структурная биология — наука, изучающая процессы в живых организмах на уровне изменения пространственной структуры отдельных макромолекул. По сути, структурная биология находится на стыке трех различных наук. Во-первых, это биология, потому что наука изучает живые объекты, во-вторых, физика, поскольку используется широчайший арсенал физических экспериментальных методов, а в-третьих, химия, так как изменение структуры молекул — объект именно этой дисциплины.
Структурная биология изучает два основных класса соединений — белки (основное «рабочее тело» всех известных организмов) и нуклеиновые кислоты (главные «информационные» молекулы). Именно благодаря структурной биологии мы знаем, что ДНК имеет структуру двойной спирали, что тРНК нужно изображать в виде винтажной буквы «Г», а в рибосоме есть большая и малая субъединицы, состоящие из белков и РНК в определенной конформации.
Глобальная цель структурной биологии, как и любой другой науки, — «понять, как все устроено». В какую форму свернута цепь белка, который заставляет клетки делиться, как изменяется упаковка фермента во время химического процесса, который он осуществляет, какими местами взаимодействуют гормон роста и его рецептор — вот вопросы, на которые отвечает эта наука. Более того, отдельной целью является накопление такого объема данных, чтобы на эти вопросы (по еще неизученному объекту) можно было ответить на компьютере, не прибегая к дорогостоящему эксперименту.
Например, нужно понять, как работает система биолюминесценции у червей [1] или грибов — расшифровали геном, на основании этих данных нашли нужный белок и предсказали его пространственную структуру вместе с механизмом работы. Стоит, правда, признать, что пока такие методы существуют только в зачаточной стадии, и точно предсказать структуру белка, имея только его ген, еще невозможно [2]. С другой стороны, результаты структурной биологии имеют применение в медицине. Как надеются многие исследователи, знания о структуре биомолекул и о механизмах их работы позволят разрабатывать новые лекарства на рациональной базе, а не методом проб и ошибок (высокопроизводительного скрининга, если говорить строго), как это делается чаще всего сейчас. И это не научная фантастика: уже есть много лекарств, созданных или оптимизированных с применением структурной биологии [3].
История структурной биологии
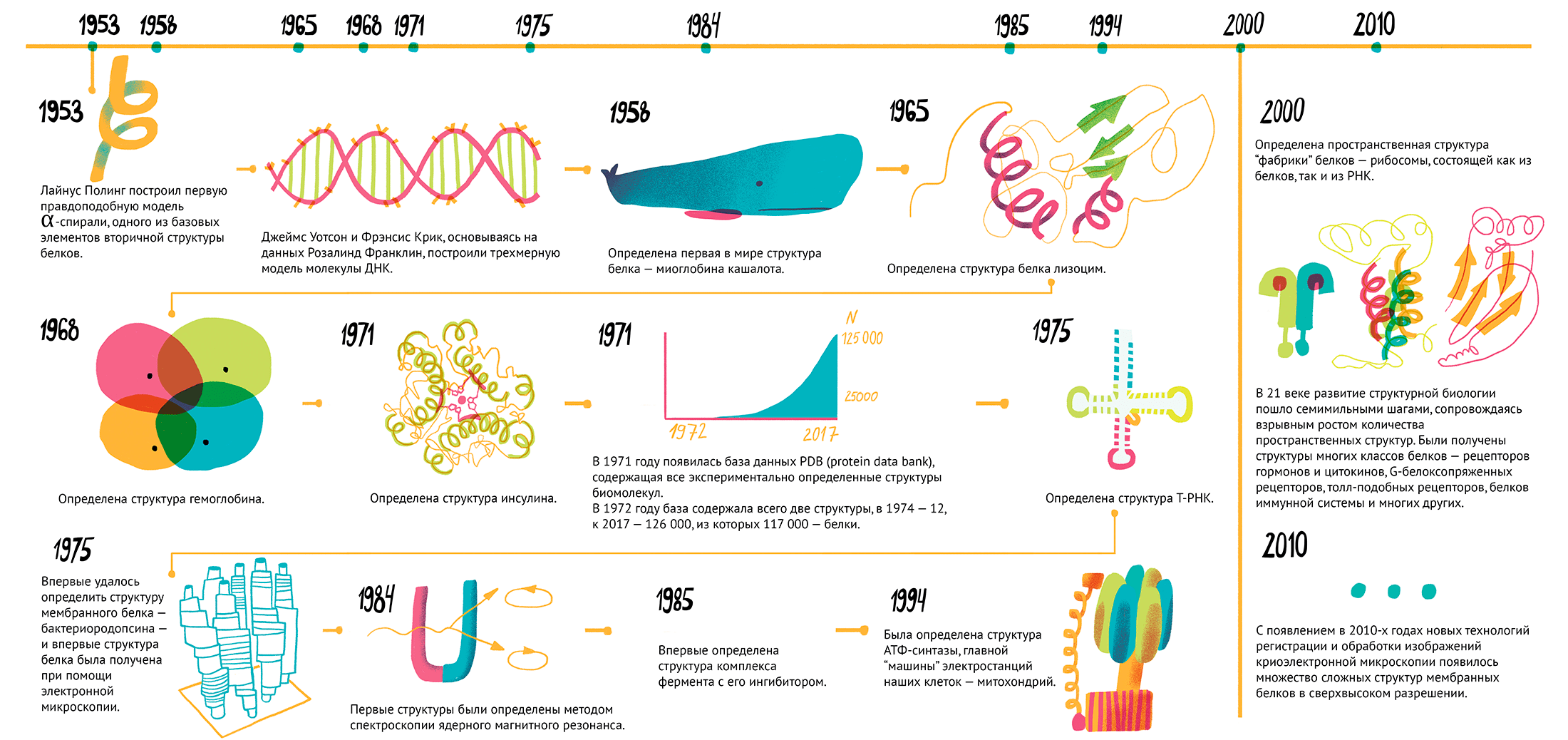
Рисунок 1. Важные этапы на пути структурной биологии. Чтобы увидеть рисунок в полном размере, нажмите на него.
История структурной биологии (рис. 1) достаточно коротка и стартует в начале 1950-х, когда Джеймс Уотсон и Фрэнсис Крик, основываясь на данных Розалинд Франклин по дифракции рентгеновских лучей на кристаллах ДНК, собрали из винтажного конструктора модель известной сейчас всем двойной спирали [4]. Чуть раньше Лайнус Полинг построил первую правдоподобную модель α-спирали, одного из базовых элементов вторичной структуры белков (рис. 2) [5].
Рисунок 2а. На заре структурной биологии. Джеймс Уотсон и Фрэнсис Крик рядом с моделью двойной спирали ДНК, собранной из конструктора.
Рисунок 2б. На заре структурной биологии. Лайнус Полинг рядом с моделью α-спирали белка.
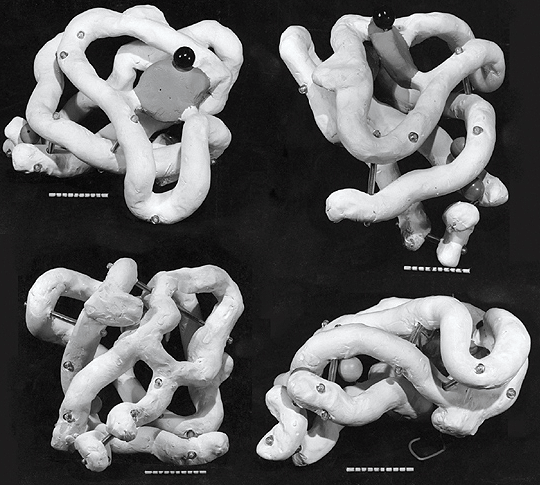
Спустя пять лет, в 1958 году, была определена первая в мире структура белка — миоглобина (белка мышечных волокон) кашалота (рис. 3). Выглядела она, конечно, не так красиво, как современные структуры, но это была значительная веха развития современной науки.
Рисунок 3а. Первая пространственная структура белковой молекулы. Некрасивая структура миоглобина низкого разрешения из статьи в Nature 1958 года [6].
Рисунок 3б. Первая пространственная структура белковой молекулы. Джон Кендрю и Макс Перутц демонстрируют пространственную структуру миоглобина, собранную из специального конструктора.
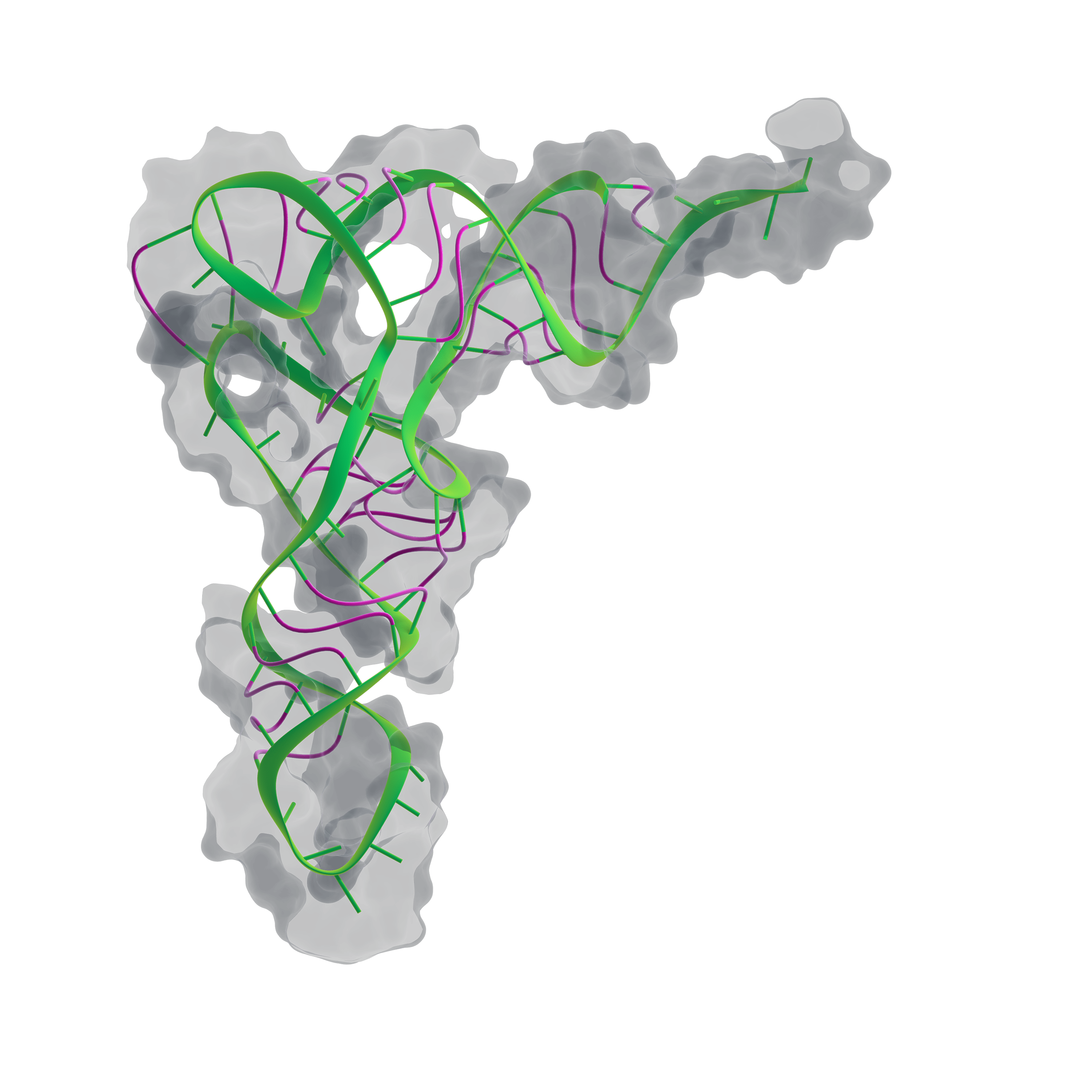
Следующая структура белка (лизоцима) появилась лишь через семь лет, но затем события ускорились. В 1968 году была получена структура гемоглобина, в 1971 — инсулина, в 1975 году получили структуру транспортной РНК (рис. 4).
Рисунок 4. Пространственная структура транспортной РНК.
Рисунок 5. Структура бактериородопсина, полученная на основе данных электронной микроскопии.
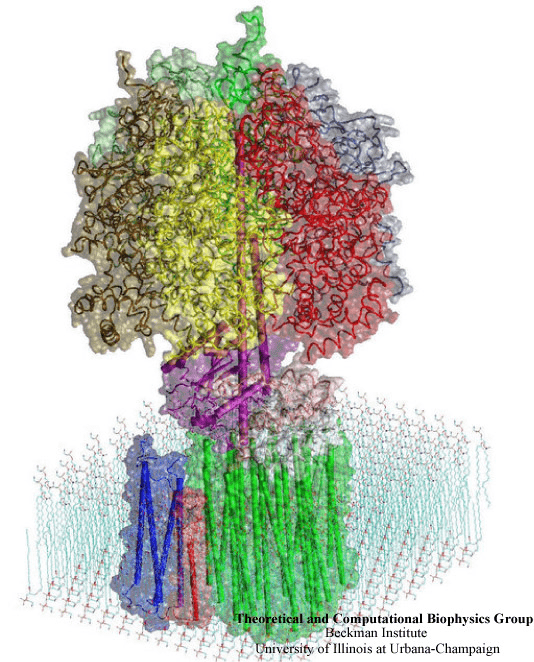
Важнейшее событие для структурных биологов произошло в 1971 году: появилась база данных PDB (Protein Data Bank), которая сейчас содержит все пространственные структуры белков, которые были получены различными методами. В 1972 году база данных содержала всего две структуры, в 1974 — 12, сегодня в ней можно найти 126 000 различных пространственных структур, из которых 117 000 — белки. В 1975 году произошло целых два «впервые». Впервые удалось получить структуру мембранного белка — бактериородопсина, — и сделали это впервые при помощи электронной микроскопии (рис. 5) [7].
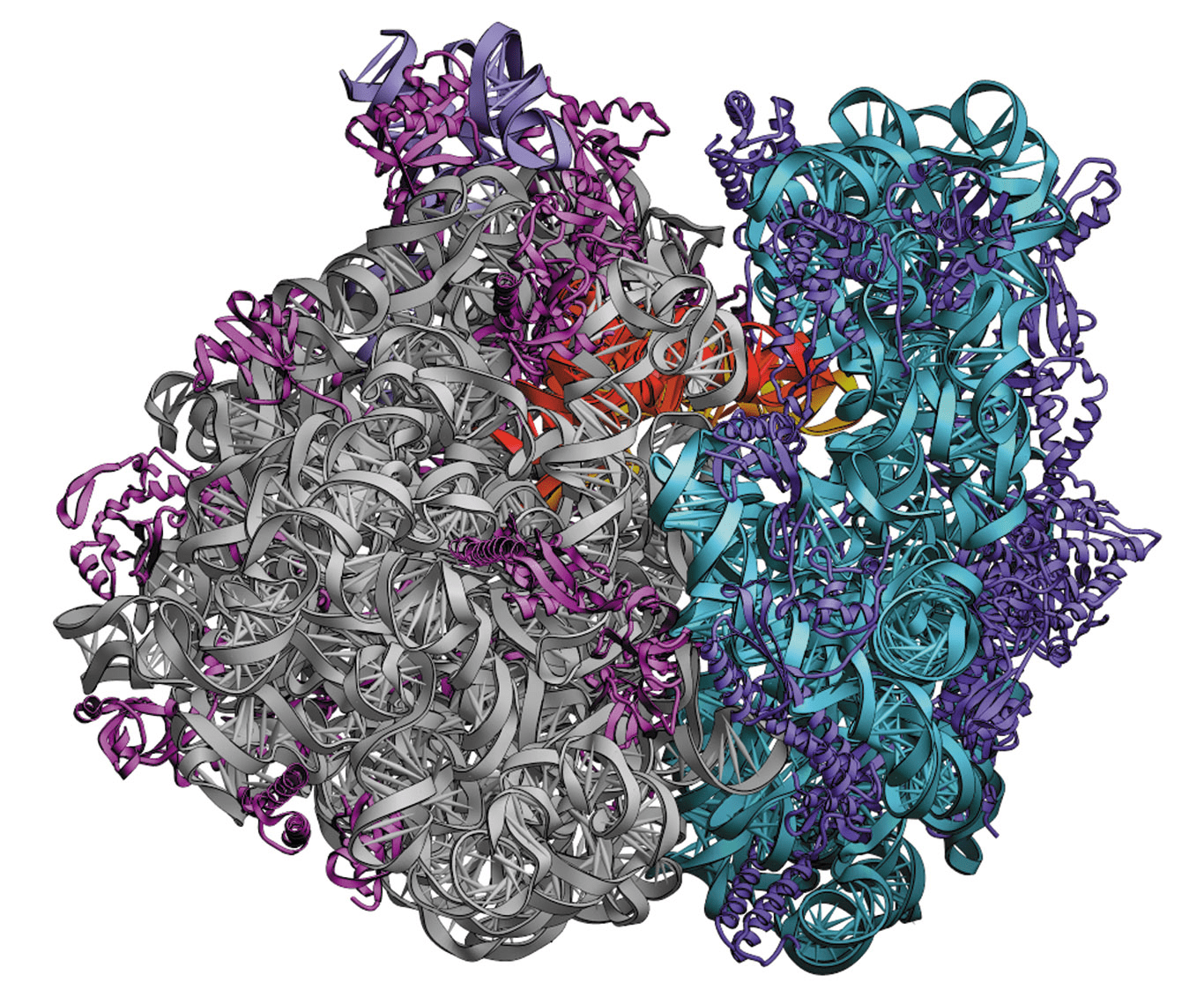
Через 10 лет, в 1984–1985 годах, первые структуры определили методом спектроскопии ядерного магнитного резонанса. С того момента произошло несколько ключевых открытий: в 1985 году получили структуру первого комплекса фермента с его ингибитором, в 1994 году определили структуру АТФ-синтазы [8], главной «машины» электростанций наших клеток (митохондрий), а уже в 2000 г. получили первую пространственную структуру «фабрики» белков — рибосомы, состоящей из белков и РНК (рис. 6) [9]. В 21 веке развитие структурной биологии пошло семимильными шагами, сопровождаясь взрывным ростом количества пространственных структур. Были получены структуры многих классов белков: рецепторов гормонов и цитокинов, G-белоксопряженных рецепторов, толл-подобных рецепторов, белков иммунной системы и многих других [10–15].
Рисунок 6а. Пространственная структура АТФ-синтазы, полученная в 1994 году. Работа удостоилась нобелевской премии.
Рисунок 6б. Пространственная структура рибосомы, полученная в 2000 году. Работа удостоилась нобелевской премии.
С появлением в 2010-х годах новых технологий регистрации и обработки изображений криоэлектронной микроскопии появилось множество сложных структур мембранных белков в сверхвысоком разрешении [16], [17]. Прогресс структурной биологии не остался незамеченным: за открытия в данной области были вручены 14 нобелевских премий, из них пять — уже в 21 веке.
Методы структурной биологии
Исследования в области структурной биологии ведут при помощи нескольких физических методов, из которых только три позволяют получать пространственные структуры биомолекул в атомарном разрешении. Методы структурной биологии основаны на измерении взаимодействия исследуемого вещества с различными видами электромагнитных волн или элементарных частиц. Все методики требуют значительных финансовых ресурсов — стоимость оборудования часто поражает воображение.
Рентгеноструктурный анализ
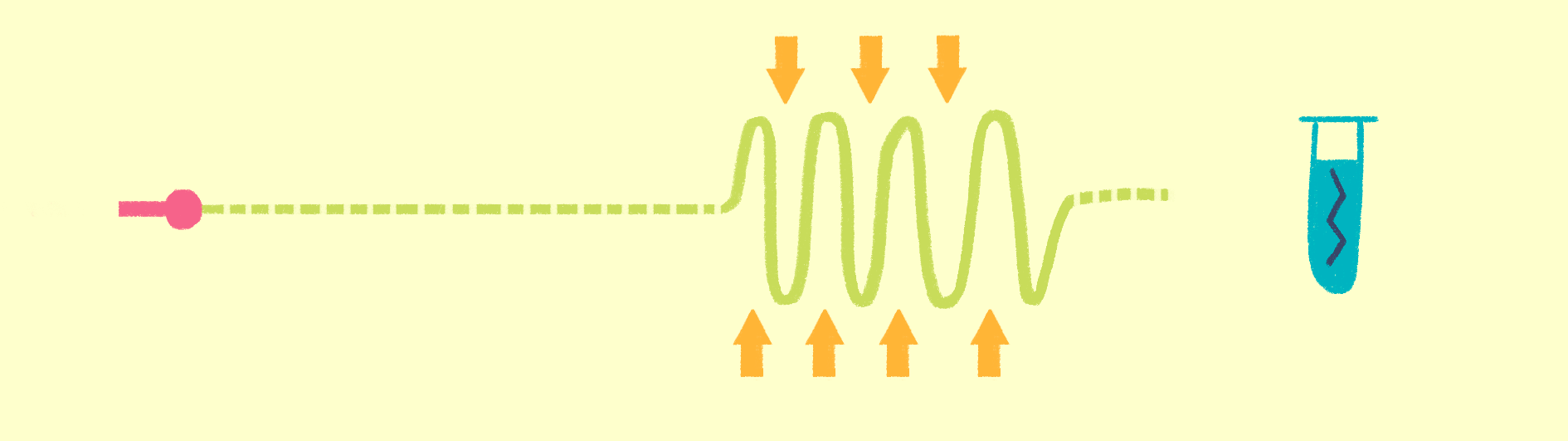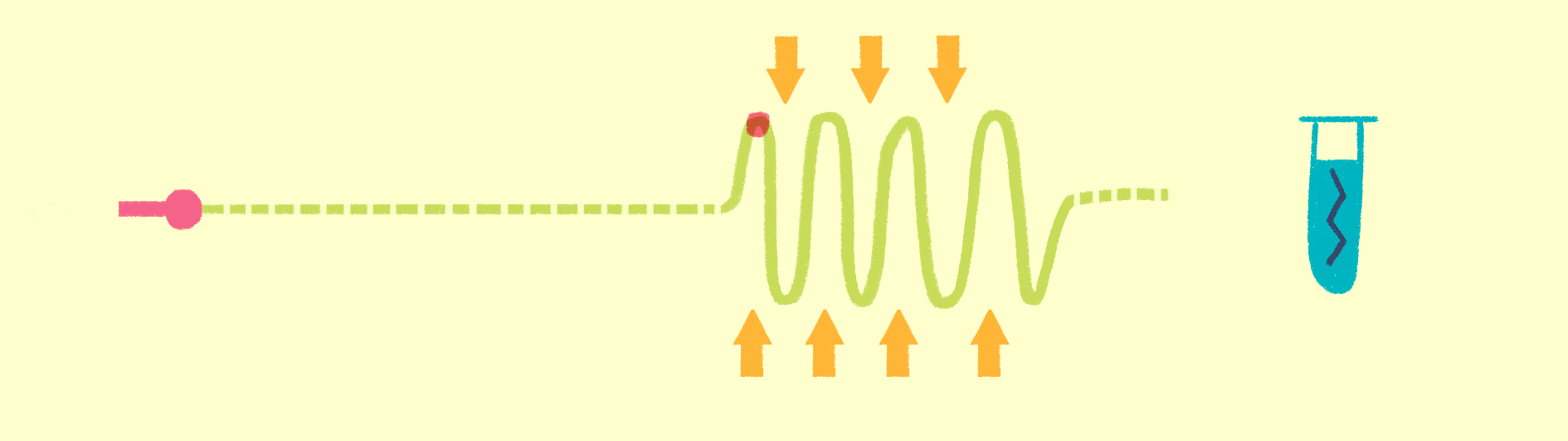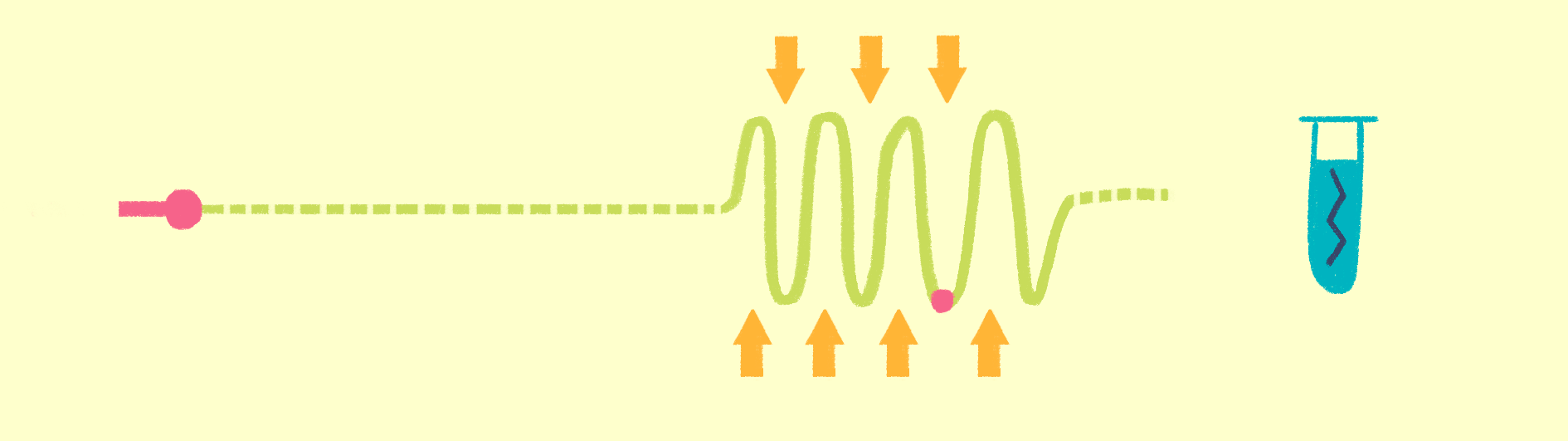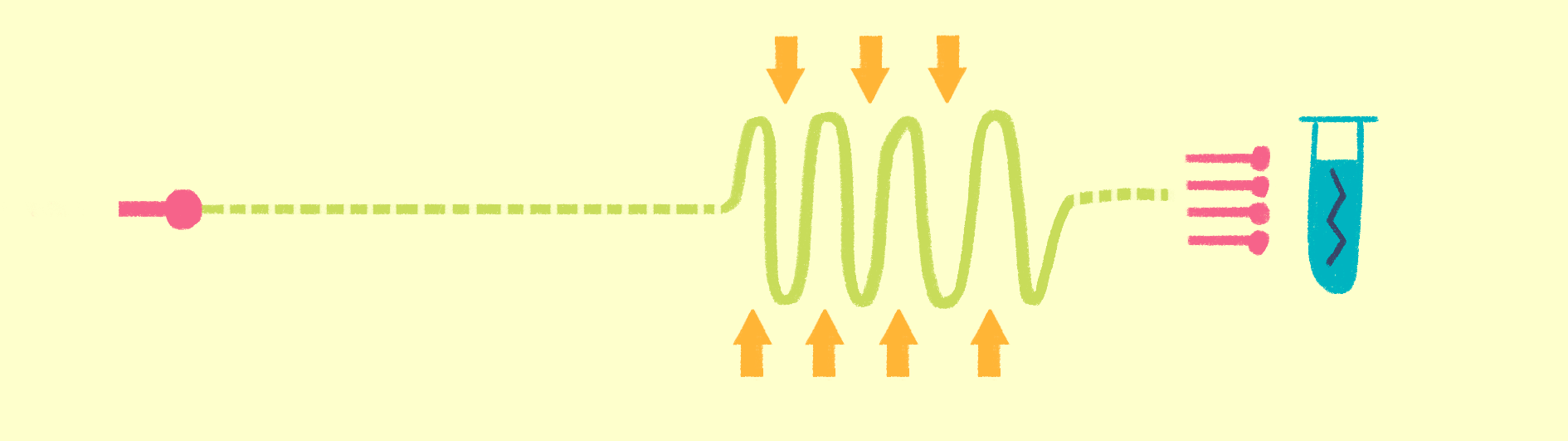
Рисунок 7. Общая схема рентгеноструктурного анализа.
Исторически первый метод структурной биологии — рентгеноструктурный анализ (РСА) (рис. 7). Еще в начале 20 века выяснили, что по картине дифракции рентгеновских лучей на кристаллах можно изучать их свойства — тип симметрии ячейки, длину связей между атомами и пр. Если же в ячейках решетки кристаллов находятся органические соединения, то можно вычислить координаты атомов, и, следовательно, химическую и пространственную структуру этих молекул. Именно так была получена в 1949 году структура пенициллина, а в 1953 году — структура двойной спирали ДНК.
Казалось бы, все просто, но есть нюансы.
Во-первых, нужно как-то получить кристаллы, причем их размер должен быть достаточно большим (рис. 8). Если для не очень сложных молекул это выполнимо (вспомните, как кристаллизуются поваренная соль или медный купорос!), то кристаллизация белков — это сложнейшая задача, требующая неочевидной процедуры поиска оптимальных условий. Сейчас это делается при помощи специальных роботов, которые готовят и мониторят сотни различных растворов в поисках «проросших» кристаллов белков [18], [19]. Однако на заре кристаллографии получение кристалла белка могло занимать годы ценного времени.
Рисунок 8а. С чем работает рентгеноструктурный анализ. Кристаллы белков, выращенные в космосе, под микроскопом.
Рисунок 8б. С чем работает рентгеноструктурный анализ. Дифракционная картина, на основании которой получают структуры белков.
Во-вторых, на основе полученных данных («сырых» дифракционных картин; рис. 8) нужно структуру «рассчитать». Сейчас это также рутинная задача, однако 60 лет назад, в эру ламповой техники и перфокарт, было далеко не так просто.
В-третьих, даже если получилось вырастить кристалл, то совсем не обязательно, что будет определена пространственная структура белка: для этого во всех узлах решетки белок должен иметь одну и ту же структуру, что далеко не всегда так.
Ну и в-четвертых, кристалл — далеко не естественное состояние белка. Изучать белки в кристаллах — это как изучать людей, впихнув их вдесятером в малогабаритную прокуренную кухню: можно узнать, что у людей есть руки, ноги и голова, но поведение может быть не совсем таким, как в комфортной обстановке. Тем не менее, рентгеноструктурный анализ — это наиболее распространенный метод определения пространственных структур, и 90% содержимого PDB получено при помощи этого метода.
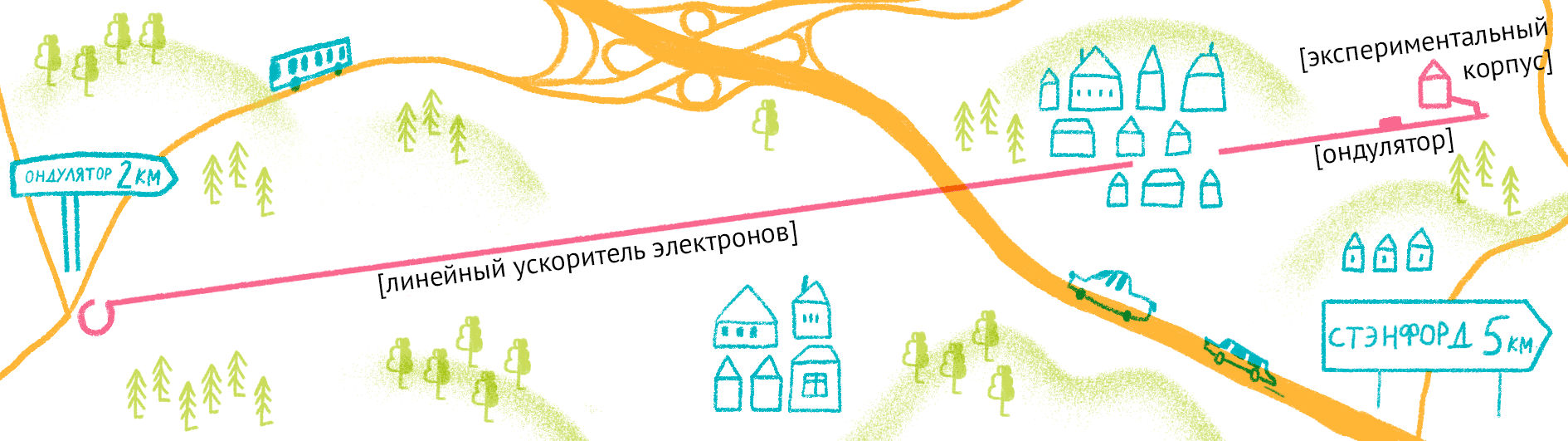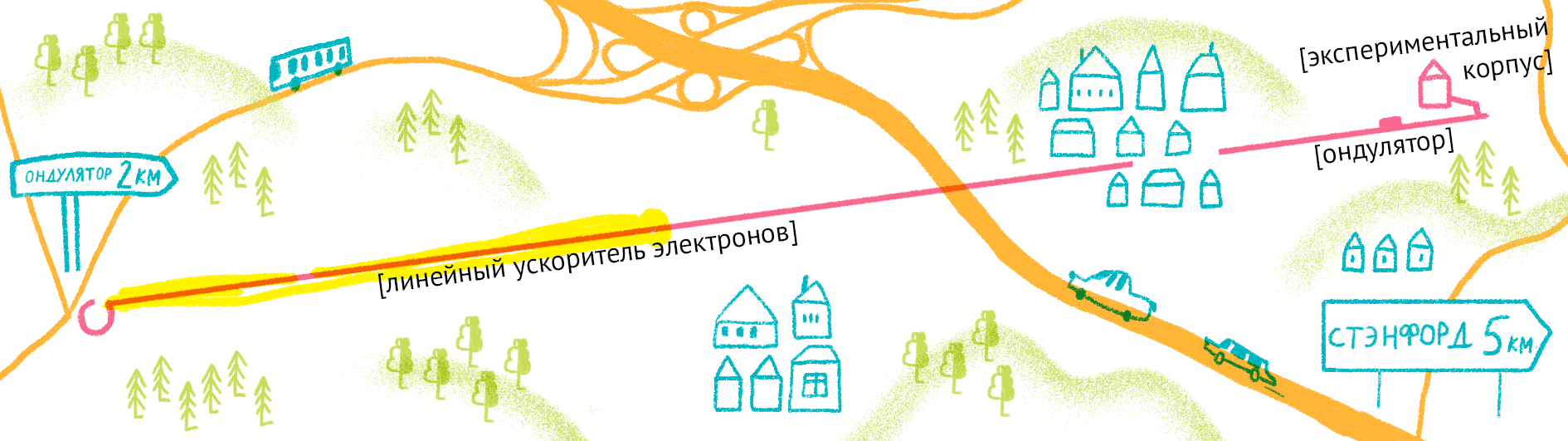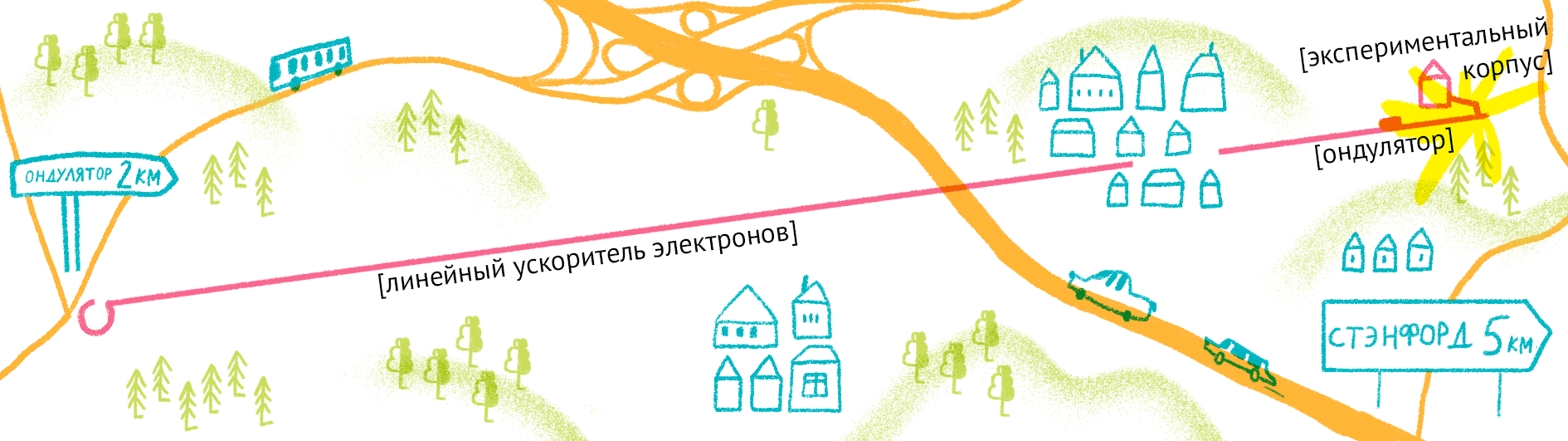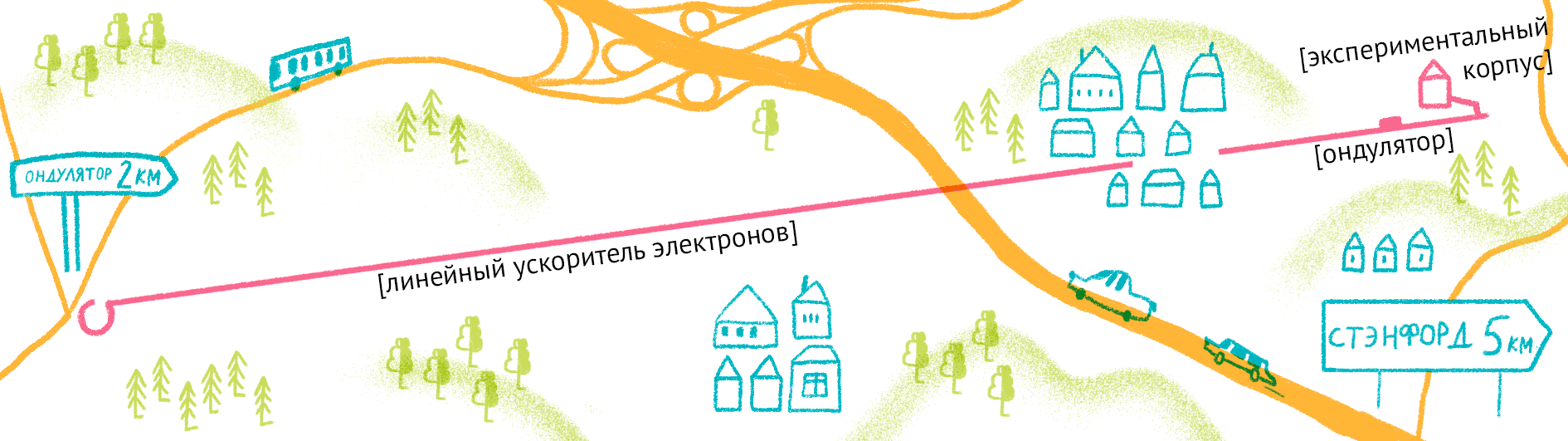
РСА требует мощных источников рентгеновских лучей — ускорителей электронов или лазеров на свободных электронах (рис. 9). Такие источники стоят дорого — несколько миллиардов долларов США, — но обычно один источник используют сотни или даже тысячи групп по всему миру за достаточно символическую плату. В нашей стране мощных источников нет, поэтому большинство ученых ездит из России в США или Европу для анализа полученных кристаллов. Подробнее об этих романтичных исследованиях можно прочесть в статье «Лаборатория перспективных исследований мембранных белков: от гена к ангстрему» [20].
Устройство лазера на свободных электронах
Как уже было сказано, для рентгеноструктурного анализа необходим мощный источник рентгеновского излучения. Чем мощнее источник, тем меньшим размером кристаллов можно обойтись, и тем меньше мучений придется испытать биологам и генным инженерам, пытающимся получить несчастные кристаллы. Рентгеновское излучение проще всего получить, ускоряя пучок электронов в синхротронах или циклотронах — гигантских кольцевых ускорителях. Когда электрон испытывает ускорение, он излучает электромагнитные волны в нужном диапазоне частот. В последнее время появились новые сверхмощные источники излучения — лазеры на свободных электронах (XFEL) [21].
Принцип работы лазера достаточно простой (рис. 9). Сначала электроны разгоняются до высоких энергий при помощи сверхпроводящих магнитов (длина ускорителя 1–2 км), а потом проходят через так называемые ондуляторы — наборы магнитов разной полярности.
Рисунок 9. Принцип работы лазера на свободных электронах. Пучок электронов ускоряется, проходит через ондулятор и излучает гамма-кванты, которые попадают на биологические образцы.
Проходя через ондулятор, электроны начинают периодически отклоняться от направления пучка, испытывая ускорение и испуская рентгеновское излучение. Поскольку все электроны движутся одинаково, то излучение усиливается за счет того, что другие электроны пучка начинают поглощать и переизлучать рентгеновские волны одной и той же частоты. Все электроны испускают излучение синхронно в виде сверхмощной и очень короткой вспышки (длительностью менее 100 фемтосекунд). Мощность рентгеновского луча настолько высока, что одна короткая вспышка превращает небольшой кристалл в плазму (рис. 10) [22], однако за те несколько фемтосекунд, пока кристалл цел, можно получить изображение высочайшего качества благодаря высокой интенсивности и когерентности луча. Стоимость такого лазера составляет 1,5 миллиарда долларов, а в мире работает всего четыре такие установки (находятся в США (рис. 11), Японии, Корее и Швейцарии). В 2017 году планируется ввод в эксплуатацию пятого — европейского — лазера, в строительстве которого участвовала и Россия.
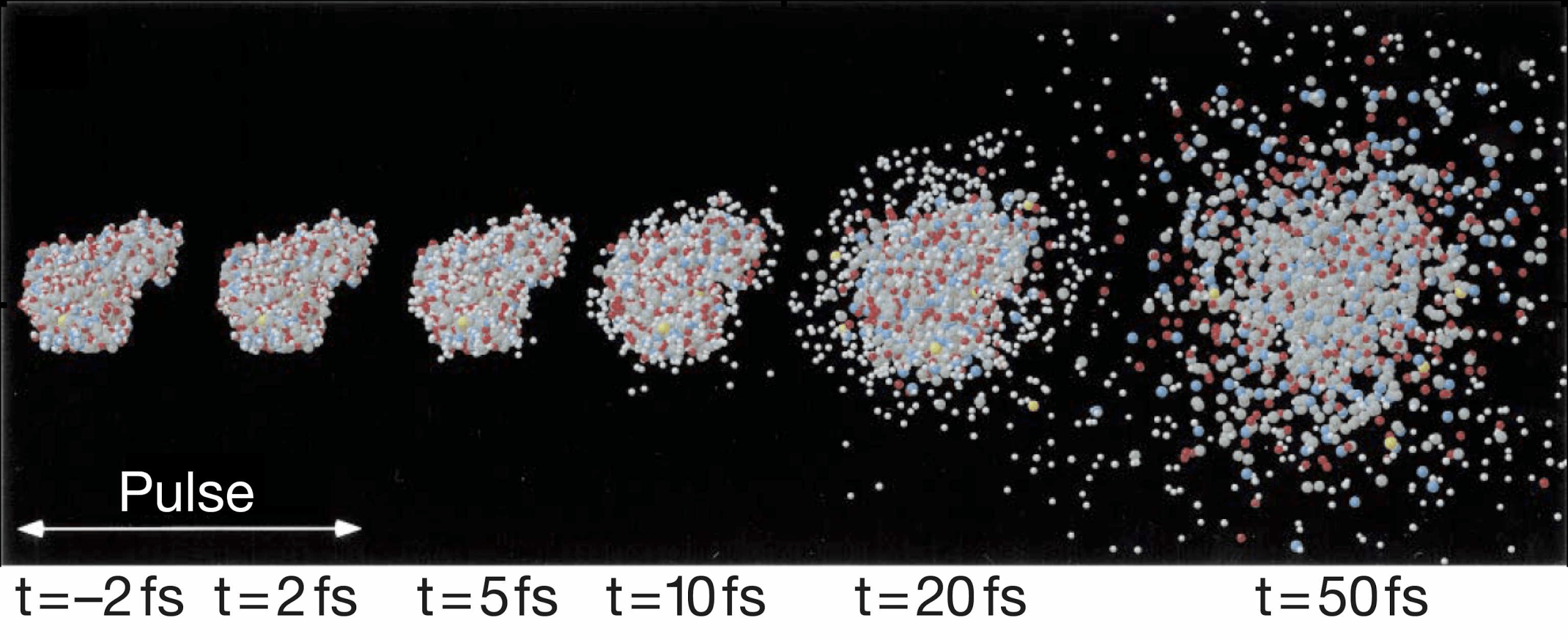
Рисунок 10. Превращение белков в плазму за 50 фс под действием импульса лазера на свободных электронах. Фемтосекунда = 1/1000000000000000 доли секунды.
Рисунок 11. Карта лазера на свободных электронах LCLS (США).