Рисдиплам что это такое
Рисдиплам
Содержание
Латинское название [ править ]
Фармакологическая группа [ править ]
Прочие препараты для лечения заболеваний костно-мышечной системы
Характеристика вещества [ править ]
Фармакология [ править ]
Данные in vitro и in vivo показывают, что рисдиплам может также вызывать сплайсинг других генов, включая FOXM1 и MADD, которые участвуют в регуляции клеточного цикла и апоптоза, соответственно, что может объяснять ряд неблагоприятных эффектов, наблюдаемых у животных.
Фармакокинетика рисдиплама линейна в диапазоне от доз от 0,6 до 18 мг. Устойчивое состояния достигается через 7–14 дней приема рисдиплама один раз в сутки.
Tmax рисдиплама составляет от 1 до 4 ч.
Объем распределения рисдиплама составляет 6,3 л/кг. Рисдиплам преимущественно связывается с сывороточным альбумином.
Клиренс рисдиплама составляет 2,1 л/ч. Период полувыведения рисдиплама составляет приблизительно 50 ч.
Применение [ править ]
Рисдиплам показан для лечения спинальной мышечной атрофии взрослых и детей от 2 месяцев.
Рисдиплам: Противопоказания [ править ]
Применение при беременности и кормлении грудью [ править ]
Рисдиплам противопоказан при беременности, женщины детородного возраста должны использовать эффективные методы контрацепции во время приема рисдиплама и в течение как минимум 1 месяца после приема последней дозы рисдиплама.
Рисдиплам: Побочные действия [ править ]
Взаимодействие [ править ]
Рисдиплам может повышать плазменные концентрации препаратов, выводимых с помощью белков-траспортеров MATE1 или MATE2-K, например, метформина. Избегайте одновременного приема рисдиплама с субстратами белков-траспортеров MATE.
Рисдиплам: Способ применения и дозы [ править ]
В России зарегистрирован второй препарат для патогенетического лечения СМА
Главная » Лекарства и исследования » В России зарегистрирован второй препарат для патогенетического лечения СМА
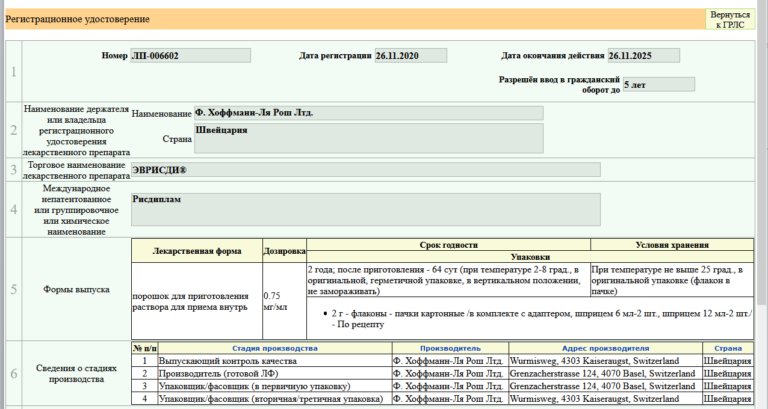
26 ноября 2020 года в России был зарегистрирован и одобрен для применения второй препарат для лечения спинальной мышечной атрофии (СМА) — рисдиплам (Эврисди). Информация об этом была добавлена в Государственный реестр лекарственных средств (регистрационный номер ЛП-006602)
Эврисди стал вторым лекарственным препаратомт, зарегистрированным в РФ, действие которого и направлено на механизм развития заболевания и предназначенный исключительно для патогенетического лечения СМА. Согласно утвержденной инструкции к препарату — Министерство здравоохранения РФ одобрило препарат рисдиплам для лечения спинальной мышечной атрофии (СМА) у взрослых и детей с двух месяцев. Таким образом, может применяться без ограничения по типу заболевания в соответствии с назначением врача.
Рисдиплам является модификатором сплайсинга (генетической модификации) гена SMN2, увеличивающим экспрессию полноразмерных функциональных белков SMN. Рисдиплам применяется перорально, минует гематоэнцефалический барьер (ГЭБ) и системно воздействует на центральную и периферическую нервную систему. Он был разработан компанией Roche в сотрудничестве с PTC Therapeutics и SMA Foundation.
Регистрационное досье на данный лекарственный препарат было представлено в Министерство здравоохранения РФ в марте 2020 года и спустя 8 месяцев препарат был зарегистрирован по ускоренной процедуре в соответствии с присвоенным ранее статусом орфанного лекарственного препарата.
Национальный Фармацевтический журнал
Войти на сайт
В США ЗАРЕГИСТРИРОВАН ПРЕПАРАТ РИСДИПЛАМ ДЛЯ ЛЕЧЕНИЯ СПИНАЛЬНОЙ МЫШЕЧНОЙ АТРОФИИ У ВЗРОСЛЫХ И ДЕТЕЙ С 2 МЕСЯЦЕВ
Компания «Рош» сообщает, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило применение препарата рисдиплам (Эврисди ® ) для лечения спинальной мышечной атрофии (СМА) у взрослых и детей в возрасте от 2 месяцев и старше. Препарат продемонстрировал клинически значимые улучшения двигательной функции в двух исследованиях с участием пациентов, представляющих различные возрастные группы и страдающих заболеванием различной степени тяжести, включая СМА 1-го, 2-го и 3-го типов.
Младенцы обретали способность сидеть без поддержки не менее 5 секунд — ключевой этап развития моторной функции, который обычно не наблюдается при естественном течении болезни. Рисдиплам также улучшил выживаемость без постоянной вентиляции через 12 месяцев и 23 месяца по сравнению с естественным течением СМА. Рисдиплам применяется в жидкой форме один раз в сутки в домашних условиях перорально или, при необходимости, через зонд для энтерального питания.
«Большинство людей со СМА в США пока не получают необходимого лечения, поэтому мы считаем, что рисдиплам с его благоприятным клиническим профилем и пероральным приемом может принести значимую пользу многим из тех, кто живет с этим редким неврологическим заболеванием, — отметил Леви Гарруэй, медицинский директор и глава глобального подразделения по разработке лекарственных препаратов компании “Рош”. — Сила и решимость СМА сообщества постоянно вдохновляли нас на этапе разработки этого первого в своем роде препарата для лечения СМА, поэтому сегодня мы отмечаем наше общее достижение вместе с ними».
Рисдиплам изучается в рамках обширной программы клинических исследований по СМА более чем у 450 пациентов. В клинических исследованиях препарата участвуют пациенты от 2 месяцев до 60 лет с различными симптомами и уровнем двигательных функций, например, со сколиозом или контрактурами суставов, а также те, кто ранее получал патогенетическое лечение по поводу СМА. Одобрение основано на данных двух клинических исследований, охватывающих широкий круг пациентов со СМА: FIREFISH у младенцев с симптомами в возрасте от 2 до 7 месяцев; и SUNFISH у детей и взрослых в возрасте от 2 до 25 лет. SUNFISH — первое и единственное плацебо-контролируемое исследование, в которое были включены взрослые со СМА 2-го и 3-го типов.
Рисдиплам продемонстрировал благоприятный профиль эффективности и безопасности, причем профиль безопасности был подтвержден в исследованиях FIREFISH и SUNFISH. Наиболее частыми побочными явлениями при позднем начале СМА были лихорадка, диарея и сыпь. При СМА с дебютом в младенческом возрасте наиболее частые побочные явления были сходными и кроме этого включали инфекцию верхних дыхательных путей, пневмонию, запор и рвоту. Не было выявлено данных о безопасности, связанных с лечением, которые бы привели к исключению пациентов из исследований.
Рисдиплам разработан для лечения СМА путем повышения уровня белка выживаемости двигательных моторных нейронов (SMN). Белок SMN присутствует во всем организме и имеет решающее значение для поддержания здоровья двигательных нейронов и сохранения двигательной функции. Компания «Рош» проводит клинические исследования препарата рисдиплам совместно с Фондом СМА (SMA Foundation) и компанией PTC Therapeutics.
Рисдиплам
Фармакологическое действие
Рисдиплам — модификатор сплайсинга мРНК, препарат для лечения мышечной атрофии позвоночника (SMA). Увеличивает системную концентрацию функциональной выживаемости белка двигательных нейронов, продуцируемого геном SMN2. Механизм действия аналогичен его предшественнику нусинерсену, наибольшее различие заключается в способе его введения: нусинерсен вводится интратекально, рисдиплам — перорально.
Рисдиплам увеличивает включение экзона 7 в транскрипты рибонуклеиновой кислоты (мРНК) SMN2 и продукцию полноразмерного белка SMN в головном мозге.
Данные in vitro и in vivo показывают, что рисдиплам может также вызывать сплайсинг других генов, включая FOXM1 и MADD, которые участвуют в регуляции клеточного цикла и апоптоза, соответственно, что может объяснять ряд неблагоприятных эффектов, наблюдаемых у животных.
Фармакодинамика
Механизм действия
Рисдиплам представляет собой модификатор сплайсинга предшественника матричной рибонуклеиновой кислоты (пре-мРНК) гена выживаемости двигательных нейронов 2 (SMN2), разработанный для лечения спинальной мышечной атрофии (СМА), причиной которой являются мутации в хромосоме 5q, что приводит к недостаточности белка SMN.
Недостаточность функционального белка SMN является патофизиологическим механизмом развития СМА всех типов. Рисдиплам корректирует сплайсинг SMN2, сдвигая баланс с исключения экзона 7 на включение экзона 7 в транскрипте м-РНК. приводя к образованию функционального и стабильного белка SMN. Таким образом, рисдиплам лечит СМА путём увеличения и сохранения уровней функционального белка SMN.
Рисдиплам равномерно распределяется во всем организме, в том числе в центральной нервной системе (ЦНС), проникая через гематоэнцефалический барьер и соответственно приводя к увеличению уровня белка SMN в ЦНС и по всему организму. Концентрации рисдиплама в плазме и белка SMN в крови отражают распределение и фармакодинамические эффекты рисдиплама в тканях, а именно: мышечных тканях и тканях мозга.
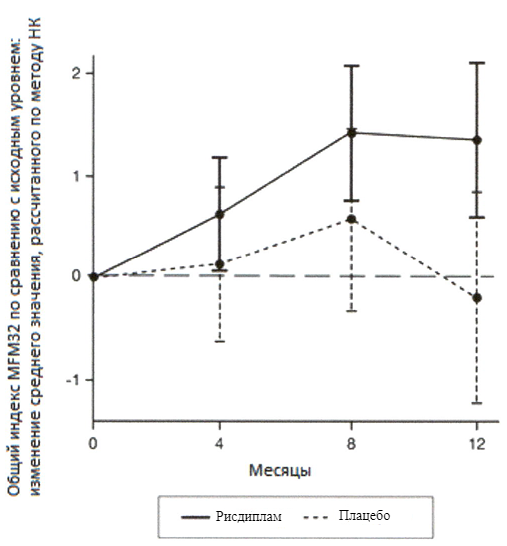
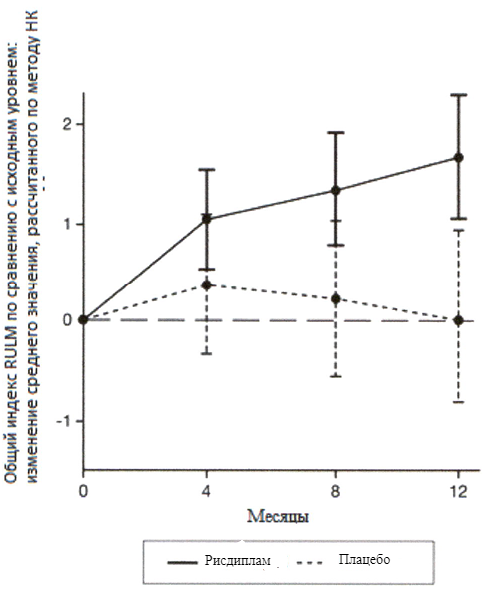
Во всех клинических исследованиях применение рисдиплама приводило к устойчивому и длительному увеличению уровня белка SMN. В течение 4 недель после начала лечения медианный уровень белка SMN был более чем в 2 раза выше по сравнению с исходным значением, согласно измерениям в крови. Повышение уровня белка SMN сохранялось на протяжении периода лечения ≤2 лет у пациентов с манифестацией СМА в младенческом возрасте и у пациентов с поздней манифестацией СМА (см. подраздел «Клиническая эффективность»).
Клиническая эффективность
Эффективность рисдиплама для лечения пациентов с манифестацией СМА в младенческом возрасте и пациентов с поздней манифестацией СМА оценивалось в 2 опорных клинических исследованиях FIREFISH и SUNFISH и подтверждено дополнительными данными, полученными в исследовании JEWELFISH. В целом результаты исследований подтверждают эффективность рисдиплама у пациентов со СМА.
Манифестация СМА в младенческом возрасте
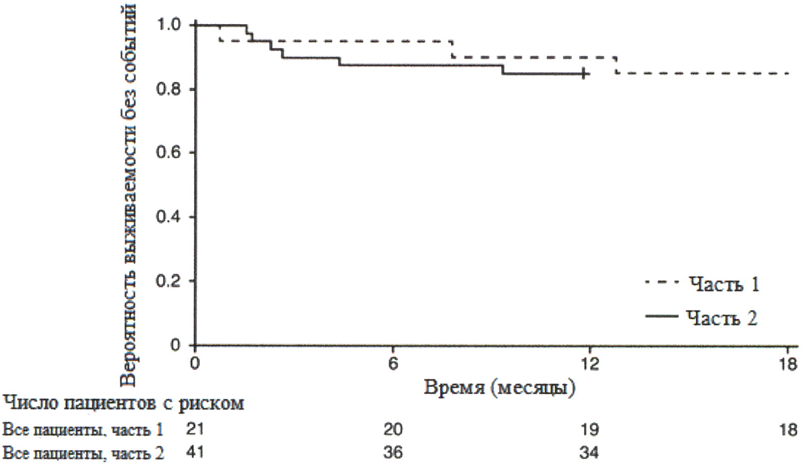
ВР39056 (FIREFISH) представляет собой открытое исследование по изучению эффективности, безопасности, фармакокинетики и фармакодинамики рисдиплама у пациентов с симптоматической СМА 1 типа (у всех пациентов было генетически подтверждено заболевание с двумя копиями гена SMN2). Исследование состоит из двух частей. Часть 1 исследования FIREFISH разработана как часть исследования по подбору дозы. В подтверждающей части 2 исследования FIREFISH оценивалась эффективность рисдиплама в терапевтической дозе, которая была выбрана на основании результатов части 1 исследования. Пациенты из части 1 не принимали участия в части 2.
В частях 1 и 2 ключевой конечной точкой по эффективности была возможность сидеть без поддержки в течение, как минимум, 5 секунд согласно измерениям по пункту 22 шкалы развития младенцев и детей Бейли — 3 издание (Bayley Scales of Infant and Toddler Development, BSID-II1, шкала крупной моторики) после 12 месяцев лечения рисдипламом.
FIREFISH часть 2
В часть 2 исследования FIREFISH был набран 41 пациент со СМА 1 типа.
Медиана возраста возникновения клинических признаков и симптомов СМА 1 типа составила 1.5 месяцев (1.0–3.0 месяцев), 54 % были женского пола, 54 % — представители европеоидной расы и 34 % — представители азиатской расы.
Медиана возраста на момент набора в исследование составила 5.3 месяцев (2.2–6.9 месяцев), медиана времени между возникновением симптомов и приёмом первой дозы составила 3.4 месяцев (1.0–6.0 месяцев).
На исходном уровне средний индекс по результатам теста детской больницы Филадельфии для оценки двигательных функций при нейромышечных заболеваниях у новорождённых (Children’s Hospital of Philadelphia Infant Test of Neuromuscular Disorders, CHOP-INTEND) составил 22 балла (8.0–37.0) и средний индекс по результатам неврологической оценки младенцев по шкале Хаммерсмита, модуль 2 (Module 2 of the Hammersmith Infant Neurological Examination, HINE-2) составил 1.0 (0.0–5.0).
Первичной конечной точкой была доля пациентов с возможностью сидеть без поддержки в течение, как минимум, 5 секунд после 12 месяцев терапии (шкала крупной моторики BS1D-11I, пункт 22). Конечные точки по эффективности у пациентов, получавших рисдиплам, сравнивали с таковыми в аналогичных группах нелеченных пациентов с манифестацией СМА в младенческом возрасте с естественным течением заболевания (критерии функционирования) — см. таблицу 1 ниже.