Резистентные штаммы микроорганизмов что это
Антибиотикорезистентность: аргументы и факты
Устойчивость к антимикробным препаратам создает угрозу для проведения эффективной профилактики и лечения постоянно возрастающего числа инфекций. Все более необходимым становится рациональное использование имеющихся антимикробных препаратов с учетом спектра их активности и профиля антибиотикорезистентности основных возбудителей. В связи с этим чрезвычайно актуально проведение научных и общественных мероприятий, направленных на обсуждение целого ряда вопросов, касающихся распространенности бактериальных инфекций, трудностей микробиологической диагностики, текущей ситуации с антибиотикорезистентностью и перспектив использования разных классов антимикробных препаратов при лечении инфекций различной локализации.
За последние 100 лет врачам удалось справиться со многими болезнями и значительно увеличить среднюю продолжительность жизни людей. Ряд открытий и изобретений в области медицины по праву можно отнести к числу наиболее значимых в прошлом столетии. Примерами могут служить появление первых кровезаменителей и расшифровка ДНК. Но, по мнению многих экспертов, именно изобретение пенициллина, внедрение его в клиническую практику и последующее бурное развитие антимикробной терапии (АМТ) сыграли наиболее существенную роль в увеличении продолжительности жизни людей в XX веке. Сегодня невозможно представить нашу жизнь без антимикробных препаратов (АМП), помогающих бороться с большинством инфекционных заболеваний [1].
Вместе с тем, в настоящее время во всем мире наблюдается совершенно объективный процесс глобальный рост антибиотикорезистентности микроорганизмов к АМП. Проблема резистентности во многом обусловлена широким и часто нерациональным использованием данных препаратов. Инфекции, вызванные резистентными штаммами микроорганизмов, характеризуются более тяжелым течением, чаще требуют госпитализации больного, увеличивают продолжительность пребывания его в стационаре, предполагают применение комбинированной АМТ с использованием резервных препаратов. Все это приводит к увеличению затрат на лечение, ухудшает прогноз для здоровья и жизни пациентов, а также создает условия для возникновения эпидемий. По данным Центра по контролю и профилактике заболеваний, в США ежегодно не менее 2 миллонов человек инфицируются бактериями, устойчивыми к антибиотикам, из которых примерно 23 тысячи умирают вследствие этих инфекций [2,3].
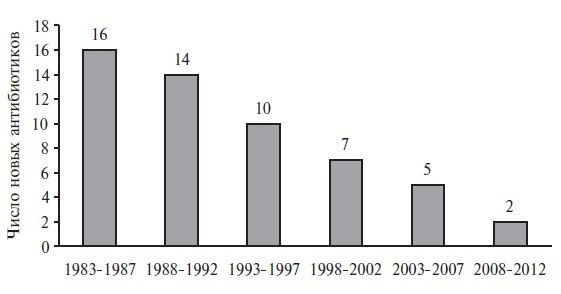
Несмотря на значительный прогресс в медицине, интенсивность разработки новых АМП за последние 30 лет значительно снизилась. Американское общество по борьбе с инфекционными болезнями в 2004 году сообщило, что за период 1998–2002 гг. количество одобренных Управлением по контролю за пищевыми продуктами и лекарственными средствами (FDA) новых антибиотиков уменьшилось на 56% по сравнению с периодом 1983–1987 г.
Во втором квартале 2014 года Всемирная организация здравоохранения опубликовала отчет об антибиотикорезистентности в мире. Это один из первых детальных докладов за последние 30 лет, касающийся столь актуальной глобальной проблемы. В нем проанализированы данные из 114 стран, в том числе России, на основании которых сделан вывод о том, что резистентность к антибиотикам на сегодняшний день отмечается уже во всех странах независимо от уровня их благосостояния и экономического развития. Российская Федерация в 2014 году со своей стороны стала инициатором подписания документа, в котором закреплено, что оценка ситуации с антибиотикорезистентностью в стране является национальным приоритетом. Сложившаяся ситуация имеет большое социально-экономическое значениеи рассматривается как угроза национальной безопасности. При неэффективности стартовой терапии клиницисты вынуждены использовать альтернативные АМП, которые часто характеризуются более высокой стоимостью и худшим профилем безопасности.
Все более необходимым становится рациональное использование имеющихся АМП с учетом спектра их активности и профиля антибиотикорезистентности основных возбудителей. В связи с этим чрезвычайно актуально проведение научных и общественных мероприятий, направленных на обсуждение целого ряда вопросов, касающихся распространенности бактериальных инфекций, трудностей микробиологической диагностики, текущей ситуации с антибиотикорезистентностью и перспектив использования разных классов АМП при лечении инфекций различной локализации [3,4].
Проблема антибиотикорезистентности
Значение проблемы антибиотикорезистентности подтверждается многими исследованиями. Согласно данным, опубликованным в 2014 году, при сохраняющихся темпах роста антибиотикорезистентности суммарные потери общемирового ВВП к 2050 году составят более 100 триллионов долларов, а количество случаев преждевременной смерти людей в два раза превысит численность населения России [5].
Монорезистентные организмы становятся полирезистентными, а затем и панрезистентными. Появилось понятие так называемых “проблемных” микроорганизмов, среди которых особенно часто, особенно в условиях стационара, где широко применяются АМП и дезинфектанты, встречаются штаммы, резистентные к тем или иным (ко всем известным) АМП. К таким микроорганизмам относятся Staphylococcus spp., Enterococcus spp., Pseudomonas aeruginosa, Acinetobacter spp., ряд штаммов бактерий семейства Enterobacteriaceae.
Одной из наиболее важных причин сложившейся ситуации является доступность АМП населению во многих странах мира и высокая частота самолечения, которое очень часто является неадекватным. Так, по данным Европейского центра по профилактике и контролю заболеваний, около 40% европейцев уверены в том, что антибиотики эффективны при простуде и гриппе.
Свой вклад в усугубление проблемы, к сожалению, вносят и врачи. Недостаточная осведомленность клиницистов относительно правил рациональной АМТ, а иногда и неспособность устоять перед настойчивыми просьбами пациентов и их родителей приводят к неоправданному или неадекватному назначению АМП. Отсутствие просветительской работы с пациентами, в частности о необходимости завершения полного курса АМТ, становится причиной досрочного прекращения лечения. Все это способствует формированию и распространению устойчивых штаммов микроорганизмов.
Многими экспертами не раз уже отмечено, что хотя генерические препараты являются важным инструментом снижения общих затрат здравоохранения, по целому ряду из них отсутствуют адекватные исследования эффективности и безопасности по сравнению с оригинальными препаратами. Несколько исследований, проведенных в Российской Федерации, продемонстрировали наличие более низких концентраций активных субстанций в ряде “псевдогенериков”, что потенциально может приводить не только к снижению эффективности терапииу конкретного пациента, но и более быстрому росту резистентности к целому классу антибиотиков. В настоящее время рассматривается возможность внесения поправок к Федеральному закону №61. Согласно предложенным поправкам для регистрации новых генериков необходимо будет проводить исследование биоэквивалентности регистрируемого генерика по сравнению с оригинальным препаратом, а не любым уже зарегистрированным генериком.
Одной из основных проблем получения достоверных данных в бактериологических лабораториях России является недостаточно хорошее оснащение. Использование нестандартизированных сред и дисков с антибиотиками приводит к получению ложных результатов. В связи с этим значительное количество данных о чувствительности различных микроорганизмов к АМП не может быть использовано для проведения рациональной эмпирической АМТ. Следует также с осторожностью относиться к публикациям в отечественных и зарубежных источниках, в которых отсутствует информация о методах определения чувствительности и критериях интерпретации результатов. Необходимо помнить о том, что данные, полученные в зарубежных странах, могут существенно отличаться от российских, поэтому их нельзя использовать для выбора АМП.
Ситуацию также усугубляет недостаточный контроль за использованием АМП в ветеринарии и сельском хозяйстве. Применение антибиотиков в животноводстве в качестве добавки в корм для скота в малых дозах для стимулирования роста является общепринятой практикой во многих промышленно развитых странах и, как известно, приводит к повышению уровня резистентности микроорганизмов. Сельскохозяйственные животные могут служить резервуаром антибиотикорезистентных бактерий Salmonella spp., Campylobacter spp., Escherichia coli, Clostridium difficile, Staphylococcus aureus (MRSA), Enterococcus faecium (VRE) [7,8].
В настоящее время учитывая потенциальное развитие антибиотикорезистентности, АМП теряют коммерческую привлекательность, что находит подтверждение в отрицательной динамике появления новых системных антибиотиков (рис. 1).
Сдерживание распространения антибиотикорезистентности
Антибиотики на сегодняшний день являются одной из самых часто применяющихся групп лекарственных средств. По данным Ассоциации международных фармацевтических производителей и ГК Ремедиум в 2014 году системные антибиотики в России занимали 4-е место в структуре амбулаторных и 2-е место в структуре госпитальных продаж готовых лекарственных средств.
В настоящее время во всем мире идет поиск альтернативных подходов к терапии инфекционных заболеваний. Одним из перспективных направлений в борьбе с инфекциями является применение бактериофагов и их компонентов. Бактериофаги природных штаммов и искусственно синтезированные генетически модифицированные фаги с новыми свойствами инфицируют и обезвреживают бактериальные клетки. Фаголизины – это ферменты, которые используются бактериофагами для разрушения клеточной стенки бактерий. Ожидается, что препараты на основе бактериофагов и фаголизинов позволят справиться с устойчивыми к АМП микроорганизмами, однако эти препараты появятся не ранее 2022-2023 гг. Параллельно с этим идет разработка препаратов на основе антибактериальных пептидов и вакцин для лечения инфекций, вызванных C. difficile, S. aureus, P. aeruginosa [9].
В последние годы резко возросла поддержка со стороны органов исполнительной и законодательной власти, а также Министерства здравоохранения Российской Федерации исследований, направленных на сдерживание антибиотикорезистентности. Так, например, Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) и Федеральный научно-методический центр мониторинга резистентности к антимикробным препаратам активно занимаются разработкой страте гических направлений по данной проблеме.
На международный уровень обсуждение данной проблемы вышло на рубеже веков. В 2001 году ВОЗ опубликовала Глобальную стратегию по сдерживанию устойчивости к противомикробным препаратам, а в 2016 году вопрос борьбы с растущей угрозой антибиотикорезистентности был вынесен на повестку дня Генеральной Ассамблеи ООН.
Входящие в ООН государства в совместном заявлении обязались разработать национальные планы мер по противодействию устойчивости микроорганизмов к АМП. Это подразумевает усиление мониторинга лекарственноустойчивых инфекций и контроля за применением АМП в медицине, ветеринарии и сельском хозяйстве, а также укрепление международного сотрудничества и финансирования. Также члены организации взяли на себя обязательства ужесточить законодательное регулирование применения АМП, заниматься поиском рационального их использования (улучшение диагностики инфекций с учетом их чувствительности к препаратам) и широко внедрять меры профилактики инфекционных заболеваний (вакцинация, очистка воды, санитария, должный уровень гигиены в стационарах и на фермах) [10].
Еще одним знаменательным событием 2016 года стало подписание ведущими международными фармацевтическими, диагностическими и биотехнологическими компаниями совместной декларации о принятии всеобъемлющих мер против инфекций, устойчивых к лекарственной терапии. Декларация была оглашена на Всемирном экономическом форуме в г. Давосе и подписана на сегодняшний день почти 100 фармацевтическими компаниями. Представители индустрии призывают правительства всех стран мира выйти за рамки заявлений о намерениях и в сотрудничестве с компаниями принять конкретные меры для поддержки инвестиций в разработку антибиотиков, средств диагностики, вакцин и других продуктов, имеющих жизненно важное значение для предотвращения и лечения лекарственно устойчивых инфекций. Одновременно с этим в Декларации устанавливаются обязательства подписавших сторон по дальнейшим действиям в области проблем лекарственной устойчивости. Компании обязуются уменьшить воздействие производства АМП на окружающую среду; содействовать надлежащему применению новых и существующих АМП, в том числе за счет поддержки рекомендаций по применению АМП; продолжать и расширять научноисследовательские разработки по созданию новых АМП; поддерживать инициативы, направленные на обеспечение доступа к АМП во всех частях света при любых уровнях доходов.
Заключение
Современная медицина немыслима без АМТ. Антибиотики во много раз сократили смертность от инфекционных заболеваний, смягчили тяжесть их течения, уменьшили количество постинфекционных осложнений. Однако, несмотря на появление в арсенале врачей значительного перечня лекарственных препаратов, активных в отношении практически всех патогенных микроорганизмов, существует значительное количество проблем и нерешенных вопросов в области АМТ [1].
В течение последних десятилетий АМТ инфекционных заболеваний существенно осложняется резистентностью возбудителей к АМП. Постоянный рост резистентности к АМП отмечен среди возбудителей как нозокомиальных, так и внебольничных инфекций. Возникновение резистентности и распространение ее среди микроорганизмов является естественным процессом, возникшим в ответ на широкое использование АМП в клинической практике, однако имеет большое социально-экономическое значение и в развитых странах рассматривается как угроза национальной безопасности. Инфекции, вызванные резистентными штаммами микроорганизмов, отличаются более тяжелым течением, чаще требуют госпитализации и увеличивают продолжительность пребывания в стационаре, ухудшают прогноз для пациентов.
Специалисты в области АМТ выделяют несколько уровней резистентности к АМП глобальный, региональный и локальный. Прежде всего, необходимо учитывать глобальные тенденции в развитии резистентности. Примерами микроорганизмов, у которых во всем мире стремительно распространяется резистентность к АМП, являются Staphylococcus spp., Enterococcus spp, Streptococcus pneumoniae, Neisseria gonorrhoeae, Pseudomonas aeruginosa, Acinetobacter spp., бактерии семейства Enterobacteriaceae и другие. При этом следует помнить, что резистентность не является тотальной. Так, например, Streptococcus pyogenes сохраняет чувствительность к пенициллину.
При планировании политики АМТ внебольничных инфекций следует более рационально опираться на локальные (региональные) данные, полученные в конкретной стране или регионе страны. В Российской Федерации существуют значительные территориальные вариации частоты резистентности возбудителей вне больничных инфекций к АМП. Вот почему необходимы постоянный мониторинг резистентности и информирование врачей различных специальностей. Наряду с региональными данными по резистентности к АМП внебольничных возбудителей в каждом ЛПУ необходимо иметь данные по резистентности нозокомиальных возбудителей, особенно в отделениях с интенсивным использованием АМП: ОРИТ, отделения хирургической инфекции, травматологии и ортопедии [4].
Хотя от адекватных назначений врачей и отказа пациентов от самолечения во многом зависит успех борьбы с проблемой антибиотикорезистентности, этих шагов, к сожалению, недостаточно. Очень многие решения должны быть приняты на национальном уровне, например, запрет на безрецептурный отпуск антибиотиков, усиление законодательства в отношении предотвращения производства и продажи фальсифицированных АМП, снижение применения антибактериальных средств в продовольственном животноводстве. Следует также отметить, что современные тенденции развития фармацевтической промышленности таковы, что гарантий появления новых групп АМП нет [11,12].
Без сомнения, эра АМП сыграла существенную роль в жизни современного общества. Однако только трезвый подход как к проблеме лечения АМП и ее принципам, так и к роли антибиотикотерапии в современном обществе способен обеспечить правильное планирование выпуска АМП и прогнозирование их эффективности в будущем.
Проклятая дюжина
Опубликован список из 12 бактерий, устойчивых к действию большинства антибиотиков
В конце февраля 2017 г. Всемирная организация здравоохранения впервые опубликовала список бактерий с уже выработанной или растущей устойчивостью к действию большинства антибиотиков. Задача публикации — стимулировать на государственном уровне поиск новых лекарственных препаратов против перечисленных возбудителей, «представляющих наибольшую угрозу для здоровья человека». Включенные в список бактерии разделены на три группы по приоритетности в плане поиска новых антибиотиков.
Критически высокий уровень приоритетности
Рейтинг бактерий, устойчивых к антибиотикам, заслуженно возглавляют грамотрицательные микроорганизмы — возбудители большинства нозокомиальных (внутрибольничных) инфекций в отделениях реанимации и интенсивной терапии, гнойной хирургии и онкологии. Вызывают инфекции кожи и мягких тканей, ЖКТ, мочевыводящих путей, раневые, эндокардит, менингит, остеомиелит. У ослабленных пациентов особое значение имеют инфекции кровотока и ИВЛ-ассоциированная пневмония. Для бактерий этой группы практически не осталось антибиотиков резерва.
Acinetobacter baumannii
«Природное» местообитание A. baumannii не установлено, однако этих бактерий обнаруживают в стационарах по всему миру. Вызывает до 1 % всех нозокомиальных инфекций, с уровнем смертности от 8 до 35 %. A. baumannii резистентна к пенициллинам, цефалоспоринам, аминогликозидам, хинолонам и тетрациклину. Отмечено значительное увеличение резистентности к карбапенемам — более 50 % в отдельных странах. Выявлены случаи резистентности к «последнему резерву» антибактериальной терапии, полимиксинам, ранее широко не использовавшимся из‑за высокой нефротоксичности.
В терапии карбапенем-резистентной A. baumannii относительно эффективны комбинации антибиотиков: полимиксин Е + рифампицин/карбапенемы/хинолоны/цефепим/ампициллин-сульбактам/пиперациллин-тазобактам.
Pseudomonas aeruginosa
Синегнойная палочка распространена повсеместно, встречается в почве и воде, на/в растениях, животных, людях. Вызывает до 20 % нозокомиальных инфекций. Чувствительность к антибактериальной терапии очень сильно варьирует. В тяжелых случаях отмечается развитие резистентности к ранее высокоэффективным цефалоспоринам, фторхинолонам, карбапенемам, аминогликозидам, азтреонаму, пиперациллину-тазобактаму. Сохраняется чувствительность к полимиксину Е, а также комбинациям антибиотиков.
Смертность при развитии инфекций, вызванных мультирезистентной P. aeruginosa, варьирует от 5 до 50 %, в зависимости от состояния пациента и локализации процесса.
Enterobacteriaceae
Из большого семейства энтеробактерий основные проблемы в стационарах доставляют Klebsiella, Escherichia coli, Citrobacter, Salmonella, Enterobacter, Serratia, Proteus. Вызывает опасения растущее повсеместное снижение чувствительности семейства к карбапенемам. Описаны единичные случаи резистентности E. coli ко всем существующим антибиотикам, включая полимиксин Е.
Высокий уровень приоритетности
Бактерии второй группы объединены по признаку повсеместного распространения, высокой социально-экономической значимости вызываемых ими заболеваний и быстрого развития резистентности к основным антибиотикам, используемым для их эрадикации, однако в резерве еще остается один или несколько эффективных препаратов.
Enterococcus faecium
E. faecium входит в состав нормальной микрофлоры кишечника, но в то же время является условно-патогенным микроорганизмом. У ослабленных больных может вызывать инфекции мочевыводящих путей, раневую инфекцию, сепсис и эндокардит. Резистентен к аминогликозидам, пенициллинам и цефалоспоринам. Беспокойство вызывает снижение чувствительности к ванкомицину — до 72 % в отдельных популяциях. Большинство штаммов E. faecium чувствительны к линезолиду, тигециклину, даптомицину.
Staphylococcus aureus
Золотистый стафилококк, колонизирующий кожу и слизистые оболочки, способен вызывать тяжелые инфекции кожи и мягких тканей, респираторные, раневые инфекции, остеомиелит, сепсис, артрит, эндокардит. Недавнее появление и распространение ванкомицин- и гликопептид-резистентных штаммов в дополнение метициллин-резистентному S. aureus значительно сужает выбор антибактериальных препаратов, однако у возбудителя сохраняется чувствительность к аминогликозидам, эритромицину, тетрациклину, ко-тримоксазолу, линезолиду.
Helicobacter pylori
Тревогу ВОЗ вызывает увеличение случаев резистентности всем известной H. pylori к кларитромицину, что сказывается на эффективности традиционных схем эрадикационной терапии, в том числе и в России. Перед эрадикацией ВОЗ рекомендует проверить чувствительность бактерии к этому антибиотику, при выявлении устойчивости — использовать схемы без него — с метронидазолом, тетрациклином или рифаксимином, а также добавлять висмута трикалия дицитрат.
Campylobacter spp.
Бактерии рода Campylobacter удерживают первое место в мире по гастроэнтеритам, которые у большинства населения планеты протекают в легкой форме, но представляют опасность для маленьких детей, беременных, стариков и иммунокомпрометированных больных. В большинстве случаев достаточно регидратации и восстановления электролитного баланса, антибактериальную терапию назначают при тяжелом течении. Проблемой является резистентность Campylobacter к фторхинолонам, основному средству борьбы с кишечной микрофлорой, и макролидам. Устойчивость к этим препаратам, впрочем, сильно варьирует от страны к стране — от менее 5 % в Финляндии до более 90 % в Индии. В Европе и России эритромицин всё еще остается препаратом выбора. По данным микробилогических исследований, в России также еще вполне актуальны фторхинолоны. В запасе для особо тяжелых случаев с осложнениями — гентамицин и карбапенемы.
Salmonellae
Представители рода сальмонелл также вызывают набор кишечных инфекций, от легкого энтерита до брюшного тифа. Большинство этих бактерий уже резистентны к бета-лактамам, аминогликозидам, тетрациклинам, хлорамфениколу и ко-тримоксазолу. Устойчивость к фторхинолонам растет во всем мире, но пока не привела к полной бесполезности этих препаратов, они остаются антибиотиками выбора, наравне с макролидами и цефалоспоринами третьего поколения. Антибактериальной терапии требуют только тяжелые случаи кишечных инфекций и, конечно, брюшной тиф и паратифы.
Neisseria gonorrhoeae
Гонорея из неприятной, но относительно легко излечимой болезни эволюционировала в глобальную медицинскую проблему. Гонококк потерял чувствительность к пенициллинам, тетрациклинам, сульфаниламидам и фторхинолонам.
Особое опасение вызывает появление и постепенное распространение штаммов, резистентных к цефалоспоринам (цефтриаксону), долгое время служивших безотказным средством борьбы с этой инфекцией. При резистентной к стандартным схемам лечения гонорее рекомендовано использовать комбинацию азитромицина с высокими дозами цефтриаксона. В России гонококк также практически резистентен к фторхинолонам, но пока сохраняет 100 %-ную чувствительность к цефтриаксону.
Средний уровень приоритетности
Третью группу также представляют широко распространенные бактерии, чья устойчивость к «обычным» антибиотикам пока не приняла угрожающих масштабов, однако чревата большими проблемами в будущем.
Streptococcus pneumoniae
Пневмококки — одни из основных возбудителей инфекций ЛОР-органов, внебольничной пневмонии, менингита. Резистентны к тетрациклину и ко-тримоксазолу. В мире постепенно снижается чувствительность S. pneumoniae к бета-лактамам и макролидам, однако, как и в других случаях, доля резистентных штаммов сильно варьирует от страны к стране. В России большинство штаммов пневмококков, к счастью, всё еще чувствительны к пенициллинам и макролидам, также эффективны хлорамфеникол, рифампицин, левофлоксацин, ванкомицин.
Haemophilus influenzae
Гемофильная инфекция у детей младшего возраста протекает в виде бактериемии, гнойного менингита, пневмонии, целлюлита и эпиглоттита, у взрослых — в основном в виде пневмонии. Тревогу ВОЗ вызывает развитие полной резистентности гемофильной палочки к ранее эффективному ампициллину, в результате чего от него пришлось повсеместно отказаться. В России эффективны амоксициллин, цефалоспорины и макролиды, однако рекомендуется проводить бактериологический анализ с оценкой резистентности.
Shigella spp.
Возбудители дизентерии практически не чувствительны к ампициллину. Как и прочие энтеробактерии, они также постепенно вырабатывают устойчивость к фторхинолонам, которые тем не менее всё еще остаются препаратами выбора. В качестве альтернативы — цефалоспорины III поколения, ко-тримоксазол.
Итого
Появление устойчивых к антибиотикам бактерий и публикация этого списка в очередной раз привлекают внимание человечества к необходимости создания — в идеале — принципиально новых средств борьбы с микроорганизмами, иначе, по пессимистичным прогнозам, из-за появления бактерий, устойчивых к антибиотикам, через несколько десятилетий одна только послеоперационная летальность может скатиться до уровня начала прошлого века. Разработка таких препаратов — занятие неблагодарное, поэтому фармацевтические компании не стремятся развивать данное направление, и ВОЗ выносит проблему на межгосударственный уровень.
Проблема лекарственной устойчивости среди возбудителей нозокомиальных инфекций — первые пять бактерий списка — актуальна и для российского здравоохранения. Остальные перечисленные микроорганизмы, по данным российских исследований, на территории РФ в целом сохраняют чувствительность к «своим» антибиотикам. Тем не менее, учитывая возросшую мобильность населения, можно ожидать завоза и распространения резистентных штаммов.
Сводная таблица: чувствительность возбудителей к антибактериальной терапии