Резидуальная опухоль молочной железы что это
Резидуальная опухоль молочной железы что это
C.C. Ерещенко, В.Ф. Семиглазов, П.В. Криворотько, Г.А. Дашян, В.О. Смирнова, А.В. Комяхов, Л.П. Гиголаева, Е.К. Жильцова
Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова, Санкт-Петербург, Россия
Введение
Лечение пациентов с местнораспространенными стадиями рака молочной железы (РМЖ), встречающимися в 20–25% случаев, уже в течение нескольких десятилетий начинается с первичной (неоадъювантной) терапии [1–3]. В последние годы неоадъювантное лечение все чаще используется и при операбельных опухолях с целью увеличения возможностей выполнения органосохраняющих операций, а также для ускоренной оценки эффективности новых видов терапии.
У 40–60% пациентов с полным клиническим ответом на системную терапию при микроскопическом исследовании гистологических препаратов выявляется резидуальная инвазивная опухоль [4]. С другой стороны, приблизительно у 20% больных с частичным клиническим ответом при микроскопическом исследовании определяется полный патоморфологический ответ (pCR). В рекомендациях по использованию критерия pCR для утверждения новых лекарственных препаратов FDA (США) определяет его как ypT0/is ypN0, что основывается на данных мета-анализа 12 тыс. пациентов, в котором обнаружено отсутствие различий в показателях выживаемости между группами ypT0 ypN0 и ypTis ypN0 [4]. Полный патоморфологический ответ (pCR) считается многими, но не всеми «суррогатным» маркером улучшения показателей выживаемости леченых пациентов [5].
Обычно под термином «постнеоадъювантное лечение» понимается терапия резидуального заболевания (остаточной инвазивной опухоли в молочной железе или в удаленных лимфатических узлах). На самом деле постнеоадъювантное лечение может предприниматься также в отношении пациентов, достигших полного патоморфологического регресса благодаря предоперационной терапии. Оно рекомендуется всем больным люминальными опухолями в виде многолетней эндокринотерапии (тамоксифен или ингибиторы ароматазы с супрессией овариальной функции агонистами ЛГ-рилизинг-гормона в пременопаузе), пациентам с HER2-позитивным ER-негативным РМЖ, достигшим pCR после неоадъювантной ХТ (таксаны, карбоплатин) в комбинации с таргетной терапией (трастузумаб±пертузумаб); рекомендуется продолжение таргетной терапии в адъюванте до года [7]. Назначение постнеоадъювантной терапии пациентам с трижды негативным РМЖ (ТНРМЖ), достигшим pCR после неоадъювантной терапии (антрацикли-ны±таксаны±карбоплатин), особенно больным с мутацией BRCA1/2, и использование PARP терапии (олапариб) остаются предметом рандомизированных клинических испытаний [8–10].
Роль дополнительной системной терапии в качестве постнеоадъювантного лечения в настоящее время изучается на пациентах с различными подтипами (фенотипами) РМЖ, особенно при самых агрессивных фенотипах: ТНРМЖ и HER2-позитивном РМЖ [11, 12].
Методы
В исследование включены сведения о 339 пациентах с РМЖ, получавших неоадъювантную системную терапию (НСТ) в НМИЦ онкологии им. Н.Н. Петрова МЗ РФ с 2015 по 2017 г.
Возраст женщин колебался от 28 до 77 лет, медиана возраста – 44 года. На амбулаторном этапе проводились следующие обследования: физикальное исследование (осмотр, пальпация), маммография, ультразвуковое исследование молочных желез, однофотонная эмиссионная компьютерная томография, совмещенная с компьютерной томографией (ОФЭКТ-КТ), трепан-биопсия опухоли с гистологическим и иммуногистохимическим исследованиями (ER, PR, Ki-67, HER2), пункционная биопсия подозрительных на метастазы подмышечных лимфатических узлов с цитологическим исследованием. На основании результатов оценки уровня экспрессии ER/PR, HER2, индекса пролиферации Ki-67, степени злокачественности (G) были определены иммуногистохимические подтипы (фенотипы) включенных в анализ пациентов.
У 102 (30,1%) больных был выявлен ТНРМЖ, у 102 (30,1%) – HER2-позитивный РМЖ, у 135 (39,8%) – люминальный В (ER+/HER2-) РМЖ. При дальнейшем анализе выяснилось, что опухоли 68 пациентов группы с HER2-позитивным РМЖ характеризовались ко-экспрессией рецепторов ER/PR и HER2, т.е. относятся ко второму варианту люминального В РМЖ. Пациенты с люминальным А РМЖ не включались в данное исследование, т.к. участвовали в отдельном исследовании неоадъювантной и постнеоадъювантной терапии.
Больные ТНРМЖ получили следующие схемы неоадъювантной терапии: 1) эрибулин+карбоплатин ×4 цикла, 24 (23,5%) пациента; 2) паклитаксел+карбоплатин×4, 26 (25,5%) пациентов; 3) AC×4 → паклитаксел×12, 13 (2,7%) пациентов; 4) паклитаксел+доксорубицин+карбо-платин×6, 37 (36,3%) пациентов.
Пациенты с ТНРМЖ с резидуальным заболеванием и регрессом 4–5-й степени по Miller-Payne и ypN+ получали две схемы адъювантной терапии: 1) FAC ×4 или АС×6, 39 (38,2%) пациентов; 2) капецитабин 4–6 циклов, 40 пациентов (39,2%).
Пациенты с HER2-позитивным РМЖ получали следующие схемы неоадъювантной терапии: 1) доцетаксел ×4 →FEC 4+трастузумаб, 8 циклов, 24 (47%) пациента; 2) АС×4 →доцетаксел×4+трастузумаб, 8 циклов, 22 (43%) пациента.
Пациенты с HER2-позитивным РМЖ с резидуальным заболеванием продолжали получать адъювантную таргетную (анти-HER2) терапию вместе (у части пациентов) с ХТ карбоплатином или капецитабином. Пациенты, достигшие 5-й степени регресса опухоли по Miller-Payne, продолжали получать трастузумаб после операции, т.е. в адъювантном режиме, до 1 года (без ХТ).
Пациенты с люминальным В (вариант ER+/HER2-) получали: 1) неоадъювантную эндокринотерапию (антиэстрогены или ингибиторы ароматазы 4 месяца), 36 (26,6%); 2) неоадъювантную ХТ АС×4 → паклитаксел×12; 3) ХТ по схеме FAC×6, 44 пациента (32,6%). 68 пациентов со вторым вариантом люминального В подтипа (ER+/HER2+) получали неоадъювантную ХТ: АС-4/FEC-4+ доцетаксел×4 →трастузумаб×4/8. У пациентов с резидуальным заболеванием (вариант ER+/HER2-) продолжалась адъювантная эндокринотерапия до 5 лет, у части из них с предварительной адъювантной ХТ.
При втором варианте (ER+/HER2+) продолжалась таргетная (анти-HER2) терапия до 1 года+ХТ с последующей эндокринотерапией до 5 лет. Адъювантная эндокрионотерапия до 5 лет проводилась и пациентам с люминальным В, достигших регресса 5-й ст. по Miller-Payne.
Материалом для исследования служили трепан-биоптаты опухолей молочной железы, взятые до начала НСТ, и хирургические препараты, полученные после ее завершения. Оценку степени лечебного патоморфоза проводили по классификации ypTNM, Miller-Payne и RCB (Residual Cancer Burden).
Результаты
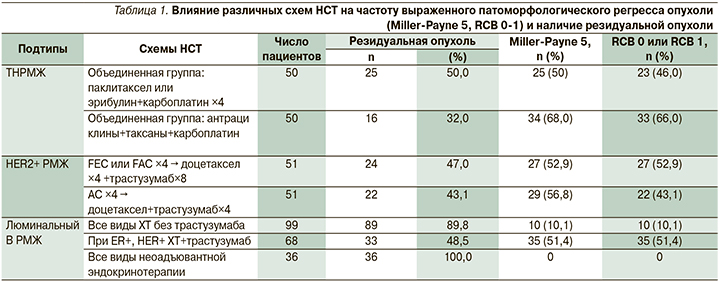
В результате проведенного неоадъювантного системного лечения выраженный патоморфологический регресс опухоли (Miller-Payne 5-й ст. или RCB 0–1) достигнут 59 (58%) из 102 пациентов с ТНРМЖ. Соответственно, у 43 (42%) пациентов выявлено резидуальное заболевание (табл. 1). Чаще всего (в 62,5% случаев) резидуальное заболевание определялось у пациентов, получавших эрибулин+карбоплатин. Реже всего (в 27% случаев) резидуальное заболевание встречалось у пациентов, получавших комплекс «паклитаксел+доксорубицин+карбоплатин», 6 циклов.
В объединенной группе пациентов, получавших таксаны+карбоплатин, резидуальная опухоль выявлена у 50% больных (табл. 2). Во 2-й объединенной группе пациентов с ТНРМЖ, получавших такую же терапию+антрациклины, резидуальная опухоль выявлялась реже (в 32% случаев; p=0,52).
У 56 пациентов (54,9%) с HER2-позитивным РМЖ достигнут патоморфологический регресс 5-й ст. по Miller-Payne. Резидуальное заболевание выявлено у 46 (45,0%) больных. При сравнении 2 групп пациентов, получавших НСТпо схеме «FAC×6, или FEC 6, или FEC×4+трастузумаб» по сравнению со схемой «АС×4 →доцетаксел×4+трастузумаб», резидуальное заболевание выявлено у 47,0 и 43,1% больных соответственно (p>0,5). Включение в схему неоадъювантной ХТ анти-HER-препаратов (трастузумаб) уравняло шансы достижения полного патоморфологического регресса (52,9 против 56,8%; p>0,5).
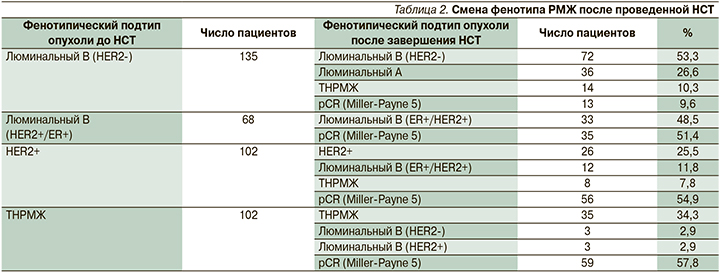
У пациентов с люминальным В-подтипом (вариант ER+/HER2-), получавших неоадъювантную эндокринотерапию (антиэстрогены или ингибиторы ароматазы), 5-я ст. патоморфологического регресса по Miller-Payne не была достигнута ни разу. У получавших неоадъювантную ХТ (АС×4 →паклитаксел×12; FAC×6), 5-я степень регресса достигнута в 10 из 99 случаев (10,1%). У 89,8% пациентов выявлена резидуальная опухоль.
При втором варианте люминального В-подтипа (ER+/HER2+) выраженный патоморфологический регресс (5-я ст. по Miller-Payne) достигнут у 35 из 68 (51,4%) пациентов, получавших неоадъювантную ХТ AC×4 или FAC×4 → таксаны+трастузумаб. У остальных (48,5%) пациентов выявлена резидуальная опухоль.
Таким образом, у пациентов с люминальным В-подтипом РМЖ с ко-экспрессией рецепторов стероидных гормонов и HER2+ добавление к неоадъювантной ХТ таргетной (анти-HER2) терапии увеличивает шансы достижения полного патоморфологического регресса по сравнению с одной ХТ и, соответственно, снижает частоту оставления резидуальной опухоли с 89,8 до 48,5% (p=0,034).
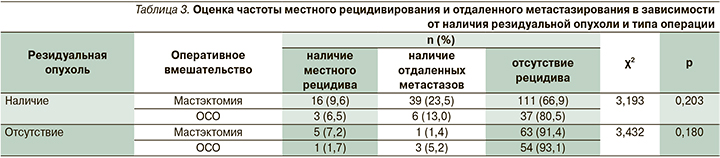
Из 339 пациентов, включенных в исследование, 235 (69,5%) подверглись мастэктомии, 104 (30,6%) проведена ораганосохраняющая операция (ОСО). Среди 212 пациентов с резидуальной опухолью 166 (78,3%) подверглись мастэктомии, 46 (21,7%) – ОСО. Среди 127 пациентов, достигших благодаря НСТ выраженного патоморфологического регресса опухоли (5-й ст. по Miller-Payne или RCB 1), 69 (54,3%) больных подверглись мастэктомии, 58 (45,7%) – ОСО. Таким образом, частота выполнения органосохраняющих операций пациентам, достигшим выраженного патоморфологического регресса опухоли (5-я ст. по Miller-Payne или RCB 0–1) RCB I), увеличивалось в 2 раза по сравнению с больными с наличием остаточной (резидуальной) опухоли (с 21,7 до 45,7%; p=0,048).
При медиане наблюдения в 41 месяц местный рецидив выявлен у 23 (10,8%) из 212 пациентов с резидуальной опухолью и у 5 (3,9%) из 127 – с выраженным патоморфологическим регрессом (5-я ст. по Miller-Payne или RCB 0–1; p=0,046). Рецидив заболевания (включая местно-региональный рецидив и отдаленные метастазы) выявлен у 74 из 339 (21,8%) пациентов, табл. 3.
При этом во всей изученной группе пациентов (безотносительно фенотипа и варианта неоадъювантного и адъювантного системного лечения) рецидив заболевания выявлен у 61(26,0%) из 235 пациентов, подвергшихся радикальной мастэктомии, и лишь у 13 из 104 (12,5%) больных, подвергшихся органосохраняющему лечению (p
1. Семиглазов В.В., Криворотько П.В., Семиглазов В.Ф. и др. Международные рекомендации по лечение раннего рака молочной железы: руководство для врачей / Под ред. В.Ф. Семиглазова. М.: МК, 2020.232 с.
2. Mauri D., Pavlidis N., Ioannidis J.P. Neoadjuvant versus adjuvant systemic treatment in breast cancer: a meta-analysis. J Natl Cancer Inst. 2005;97:188–194. Doi: 10.1093/jnci/dji021.
3. Semiglazov V.F., Topuzov E.E., Bavli J.L., et al. Primary (neoadjuvant) chemotherapy and radiotherapy compared with primary radiotherapy alone in stage IIb–IIIa breast cancer. Ann Oncol. 1994;5:591–95. Doi: 10.1093/oxfordjournals.annonc.a058929.
4. Cortazar P., Zhang L., Untch M., et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet. 2014;384:164–72. Doi: 10.1016/S0140-6736(13)62422-8.
5. Семиглазов В.Ф., Криворотько П.В., Семиглазова Т.Ю. и др. Рекомендации по лечению рака молочной железы. М.: Мегаполис, 2017. 168 с.
6. Curigliano G., Burstein H.J., Winer E.P., et al. De-escalating and Escalating Treatments for Early-Stage Breast Cancer: The St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer 2017. Ann Oncology. 2017,28:1700–12. Doi: 10.1093/annonc/mdx308.
7. Cardoso F., Kyriakides S., Ohno S., et al. Early breast cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow up. Ann Oncol. 2019,30:1194–220.
8. Robson M., Im S.A., Senkus E., et al. Olaparib for metastatic breast cancer in patients with a germline BRCA mutation. N Engl J Med. 2017;377:523–33. Doi: 10.1056/NEJMoa1706450.
9. Litton J.K., Rugo H.S., Ettl J., et al. Talazoparib in patients with advanced breast cancer and a germline BRCA mutation. N Engl J Med. 2018;379:753–63. Doi: 10.1056/NEJMoa1802905.
10. Miller K., Tong Y., Jones D.R., et al. Cisplatin with or without rucaparib after preoperative chemotherapy in patients with triple negative breast cancer: final efficacy results of Hoosier Oncology Group BRE09-146. J Clin Oncol. 2015;33(Suppl. 15):abstract 1082. Doi: 10.1200/jco.2015.33.15_suppl.1082.
11. Diéras V., Miles D., Verma S., et al. Trastuzumab emtansine versus capecitabine plus lapatinib in patients with previously treated HER2-positive advanced breast cancer (EMILIA): a descriptive analysis of final overall survival results from a randomised, open-label, phase 3 trial. Lancet Oncol. 2017;18:732–42. Doi: 10.1016/S1470-2045(17)30312-1.
12. Gunter von Minckwitz P.C. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet. 2014;384:164–72. Doi: 10.1016/S0140-6736(13)62422-8.
13. Masuda N., Lee S.J., Ohtani S., et al. Adjuvant capecitabine for breast cancer after preoperative chemotherapy. N Engl J Med. 2017;376:2147–59. Doi: 10.1056/NEJMoa1612645.
14. von Minckwitz G., Huang C.S., Mano M.S., et al. Trastuzumab emtansine for residual invasive HER2-Positive breast cancer. N Engl J Med. Epub ahead of print 5 December 2018. Doi: 10.1056/NEJMoa1814017.
15. Symmans W.F., Wei C., Gould R., et al. Long-term prognostic risk after neoadjuvant chemotherapy associated with residual cancer burden and breast cancer subtype. J Clin Oncol. 2017;35:1049–60. Doi: 10.1200/JCO.2015.63.1010.
16. Law M.E., Corsino P.E., Narayan S., et al. Cyclindependent kinase inhibitors as anticancer therapeutics. Mol Pharmacol. 2015;88:846–52. Doi: 10.1124/mol.115.099325.
17. Finn R.S., Crown J.P., Lang I., et al. The cyclindependent kinase 4/6 inhibitor palbociclib in combination with letrozole versus letrozole alone as first-line treatment of oestrogen receptor-positive, HER2-negative, advanced breast cancer (PALOMA-1/TRIO-18): a randomised phase 2 study. Lancet Oncol. 2015;16:25–35. Doi: 10.1016/S1470-2045(14)71159-3.
18. Sledge G.W., Toi M., Neven P., et al. MONARCH 2: abemaciclib in combination with fulvestrant in women with HR+/HER2− advanced breast cancer who had progressed while receiving endocrine therapy. J Clin Oncol. 2017;35:2875–84. Doi: 10.1200/JCO.2017.73.7585.
19. Slamon D.J., Neven P., Chia S., et al. Phase III randomized study of ribociclib and fulvestrant in hormone receptor–positive, human epidermal growth factor Receptor 2–Negative advanced breast cancer: MONALEESA-3. J Clin Oncol. 2018;36:2465–72. Doi: 10.1200/JCO.2018.78.9909.
20. Semiglazov V.F., Semiglazov V.V., Dashyan G.A., et al. Phaze II randomized trial of primary endocrine therapy versus chemotherapy in postmenopausal patients with estrogen receptor positive breast cancer. Cancer. 2007;110(2):244–54. Doi: 10.1002/cncr.22789.
21. Sinn H.P., Schneeweiss A., Keller M., et al. Comparison of immunohistochemistry with PCR for assessment of ER, PR, and Ki-67 and prediction of pathological complete response in breast cancer. BMC Cancer. 2017;17:124. Doi: 10.1186/s12885-017-3111-1.
22. Семиглазов В.Ф., Криворотько П.В., Семиглазов В.В. и др. Иммунология рака молочной железы. М.: СИМК, 2019.
23. Hamy A., Pierga J., Sabalia A., et al. Stromal lymphocyte infiltration after neoadjuvant chemotherapy is associated with aggressive residual disease and lower disease-free survival in HER2-positive breast cancer. Ann Oncol. 2017;28(9):2233–40.
24. Salgado R., Denkert C., Demaria S., et al. The evaluation of tumor-infiltrating lymphocytes (TILs) in breast cancer recommendations by an International TILs Working Group 2014. Ann Oncol. 201;26(2):259–71.
25. Pohlmann P.R., Diamond J.R., Hamilton E.P., et al. Atezolizumab+ nab-paclitaxel in metastatic triple-negative breast cancer: 2-year update from a phase Ib trial. Poster presented at 2018 American Association for Cancer Research Annual Meeting; April Meeting; April 14–18, 2018; Chicago, Illinois.
26. Gianni L., Eiermann W., Semiglazov V., et al. Neoadjuvant chemotherapy with trastuzumab followed be adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2-positive locally advanced breast cancer (the NOAH trial): a randomized controlled superiority trial with a parallel HER2-negative cohort. Lancet. 2010;375:377–84.
27. Miles D., Gligorov J., Andre F., et al. Primary results from Impasion 131, double-blind placebo-controlled randomized phase 3 trial of paclitaxel ± atezolizumab as first – line therapy for inoperable locally advanced/metastatic triple-negative breast cancer (mTNBC). SABCS. 2019;Dec 12:0–5.
Об авторах / Для корреспонденции
Автор для связи: В.Ф. Семиглазов, д.м.н., чл.-корр. РАН, профессор, зав. научным отделением, главный науч. сотр. научного отделения опухолей молочной железы, НМИЦ онкологии им. Н.Н. Петрова, Санкт-Петербург, Россия; e-mail: vsemiglazov@mail.ru
Адрес: 197758, Россия, Санкт-Петербург, пос. Песочный, ул. Ленинградская, 68
SPIN-код/AuthorID:
С.С. Ерещенко, SPIN-код: 5957-9137; AuthorID: 946143
В.Ф. Семиглазов, SPIN-код: 3874-9539; AuthorID: 105032
П.В. Криворотько, SPIN-код: 2448-7506; AuthorID: 356650
Г.А. Дашян, SPIN-код: 6989-7148; AuthorID: 308821
В.О. Смирнова, SPIN-код: 8106-5706; AuthorID: 928378
Е.К. Жильцова, SPIN-код: 3045-1704; AuthorID: 321963
А.В. Комяхов, SPIN-код: 8286-4406; AuthorID: 890949
Рак молочной железы — всё, что вы хотели узнать
По данным Всемирной организации здравоохранения рак молочной железы является наиболее распространённым видом рака: в 2020 г. было зарегистрировано свыше 2,2 миллиона случаев этого заболевания.
В то же время рак молочной железы является и главной причиной смерти женщин от онкологических заболеваний. Встаёт закономерный вопрос: почему, если выявленный на ранний стадии рак может быть излечим?
Основная проблема в том, что болезнь на столь ранней стадии или не имеет или имеет мало клинических проявлений, часто у женщины на приёме у врача жалоб нет.
С целью выявления бессимптомных ранних форм рака и предраковых заболеваний были созданы программы скрининга. Скрининг – это в данном случае комплексное врачебное обследование здоровых женщин с определённым временным интервалом.
В странах с развитыми программами скрининга (раннего выявления заболевания у бессимптомных женщин) рака груди и стандартизированными подходами к лечению и ведению данных пациентов по данным ВОЗ удалось добиться 40% (!) снижения смертности с 80-х гг, т.е. смертность снизилась почти в 2 раза.
На пути к визиту к врачу часто встаёт незнание, страх диагноза и результатов и процесса последующего лечения, многие вспоминают результаты лечения родственниц в 80-90-е гг. например, перенёсших мастэктомию по Холстеду (когда полностью удаляются молочная железа, сосково-ареолярный комплекс, большая и малая грудные мышцы, а также клетчатка подмышечной, подлопаточной и подключичной зон вместе со всеми лимфоузлами. Эта операция считалась прорывом в лечении рака груди. В дальнейшем она уступила место более прогрессивным методам хирургического вмешательства, не предполагающим столь обширного иссечения тканей.
При своевременном выявлении предраковых заболеваний груди, можно избежать или предупредить развитие рака.
Обнаруженное же на более поздней стадии онкологическое заболевание груди требует в 2,5 раза чаще проведения химиотерапии и в 3,5 раза чаще женщинам приходится удалять всю грудь (матэтомия).
Спасение и высокое качество жизни пациентки с раком груди в данном случае комплексная работа самой пациентки (редко пациента, т.к. болезнь может развиваться и у мужчин) и команды врачей.
В центрах сети «РЭМСИ Диагностика Рус» есть необходимые методы диагностики для выявления заболеваний груди (УЗИ, Маммография, МРТ с в\в контрастным усилением). Записаться на обследование и узнать больше информации можно по телефону.
В случае семейной предрасположенности к раку груди, при подтверждении носительства BRCA1/BRCA2 онкогенов или в случае радиационного воздействия на грудь, возрастом начала ежегодного обследования следует считать 30 лет, целесообразно добавить к УЗИ МРТ маммографию с в\в контрастированием в протокол обследования. Необходимо знать, что у молодых женщин (возрастная группа до 40 лет) молочная железа имеет довольно плотное строение, на фоне которого затруднительно выявить тканевые образования по данным маммографии (это типы строения C(3) или D(4) в зависимости от классификаций, которыми пользуется врач), в этом случае можно использовать комбинацию УЗИ + МРТ с в/в контрастным усилением или УЗИ + маммография (поиск микрокальцинатов) +МРТ с в/в контрастным усилением.
Маммография, усиленная опцией томосинтеза поможет избежать как пропуск мелкого образования, так и предупредит гипердиагностику.
МРТ исследование БЕЗ контрастирования для выявления злокачественной опухоли малоинформативно.
Когда рекомендуется дополнить к «золотой» стандарту (УЗИ + маммографии) методом МРТ с в/в контрастированием?
В России проведение скрининговых обследований молочных желёз осуществляется в рамках приказа М3 РФ от 13.03.2019 № 124н «Об утверждении порядка проведений профилактического медицинского осмотра и диспансеризации определённых групп взрослого населения» у женщин в возрасте 40-75 лет включительно — подробнее Вы можете уточнить у вашего участкового врача.
Возможно для знания о том как правильно относится к заболеваниям молочной железы Вам будет удобнее воспользоваться схемой маршрутизации пациентов приведённой проф. Рожковой Н.И.:
1. Самообследование молочных желёз (ежемесячно)
2. Клиническое обследование у врача-специалиста (осмотр и пальпация) –не реже 1 раза в 2 года
3. Для женщин в возрастной группе от 19 до 39 лет:
Анкетирование на предмет выявления повышенных факторов риска развития рака груди:
4. Если по результатам вышеописанного обследования у женщин выявлены изменения в молочных железах или среди всех женщин возрастной группы от 39 до 75 лет:
4.1. Если по результатам вышеописанного обследования женщина попала в категорию «Здоровая» — Маммография не реже один раз в 2 года (УЗИ) (даже при отсутствии жалоб)
4.2. Если по результатам вышеописанного обследования женщина попала в категорию «Мастопатия» — консервативное лечение у маммолога
4.3. Если по результатам вышеописанного обследования женщина попала в категорию «узловые образования» — дальнейшее обследование в территориальном онкологическом диспансере у онкомаммолога с применением инвазивных технологий (с биопсией). При раке-иммуногистохимия, специализированное лечении, мониторинг.
Подробнее о методиках, показаниях, подготовке к исследованиям, времени процедуры
Все методы диагностически ценны, отражают разные аспекты изменений, дополняют друг друга и позволяют создать целостнее представление о болезни.
Маммография
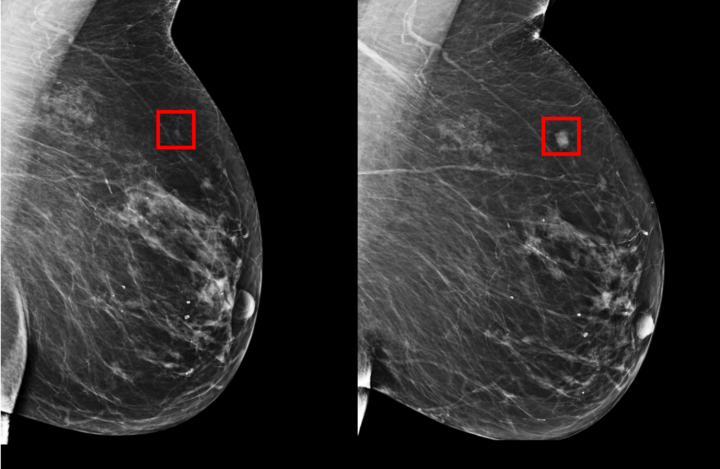
Маммография наиболее широко распространённый метод лучевой диагностики заболеваний молочной железы. Во время этой процедуры специальный прибор — маммограф — получает изображения вашей молочной железы под разными углами. Минимально необходимым является выполнение минимум 2 снимков для каждой молочной железы (в прямой и косой медиолатеральной (в переводе на обычный язык боковой под углом) проекциях).
Исследование проводят на 5-9 день менструального цикла (считать надо с первого дня последней менструации), в менопаузу в любой день.
Во время проведения маммографии грудь уплощается и сдавливается между двумя прозрачными пластинами в течение нескольких секунд, пока лаборант получает картинку, в наших центрах. Лаборант выполняет несколько снимков под разными углами. Не беспокойтесь, если он сделает дополнительные снимки, в некоторых ситуациях это необходимо для уточняющей диагностики.
Обратите внимание, что следует сообщить лаборанту о наличии родинок, шрамов, или врождённого втяжения соска груди и попросить зафиксировать этот факт в сопровождающей медицинской документации или внести эти данные в анамнестическую анкету, которая выдаётся перед исследованием.
В день проведения маммограммы нельзя использовать дезодорант или минеральную косметику/мази/кремы для груди, потому что порошок, присутствующий в их составе, создаёт на изображении груди дополнительные тени, похожие на признаки рака — микрокальцинаты. Если вы уже использовали дезодорант, следует салфеткой тщательно его убрать в пределах не затронутых им тканей, эту манипуляцию можно провести в дамской комнате или в процедурной перед исследованием.
Если вы делали маммографию раньше в другом мед учреждении, стоит взять с собой снимки/снимки на цифровых носителях и копии прошлых протоколов или попросить переслать их по почте в медицинский центр. Сравнение новых и старых изображений помогают точнее выявить минимальные изменения в Вашей груди, оценить возрастные особенности и эффект от лечения.
Продолжительность процедуры в среднем составляет: 15 мин
Томосинтез молочных желёз
Метод трёхмерно визуализации и рентгенологического послойного изучения структуры, по данным исследований на 25% повышает возможности дифференциальной диагностики ряда заболеваний на самых ранних стадиях развития.
Методика проведения аналогична маммографии.
Показания:
Продолжительность процедуры в среднем составляет: 15 мин.
В МЦ РЭМСИ на пл. Конституции — томосинтез включён в каждое маммографическое исследование
УЗИ молочных желёз
Продолжительность процедуры в среднем составляет: 15 мин.
Показания:
МРТ — маммография с контрастным усилением
Обратите внимание к процедуре есть противопоказания к которым относится наличие электронных имплантируемых устройств и нефиксированных ферромагнитных металлических объектов в организме или отягощённый аллергоанамнез (подробнее с противопоказаниями можно ознакомиться по ссылке).
Исследование проводят на 5-9 день менструального цикла (считать надо с первого дня последней менструации), в менопаузу в любой день.
Зубные импланты и маточные спирали к противопоказаниям не относятся- с ними МРТ молочных желёз проходить можно.
МРТ исследование БЕЗ контрастирования для выявления злокачественной опухоли малоинформативно.
Показания:
Продолжительность процедуры в среднем составляет: 50 мин.
Результаты диагностики
По итогам обследования в наших центрах диагностические находки в молочных железах относятся к определённой категории согласно международным стандартам Breast Imaging Reporting And Data System (BI-RADS):
Категория – 2 — доброкачественные изменения – подразумевающие плановое обследование у врача 1 раз в 1 или 2 года
Категория – 3 – возможно, доброкачественные изменения, требуют врачебного контроля через короткий промежуток времени – 1.5 или 3 или 6 месяцев на усмотрение лечащего врача
Категория – 6 — морфологически верифицированные случаи рака молочной железы-лечение у онкомаммолога
При разных методах исследования используются свои шкалы и оценки по данным УЗИ, МРТ, Маммографии могут не совпадать. Для суммарной оценки используется максимальное значение BI-RADS категории, выявленное любым методом, для каждой молочной железы.
Если на ранних стадиях рак молочной железы практически не имеет симптомов. Как же его можно выявить?
Попробуем разобраться с наиболее частыми вопросами:
Что может сделать/определить пациентка/пациент самостоятельно?
На что стоит обратить свое внимание?
В шутливой форме основные симптомы заболевания груди изображены на популярной картинке ниже:
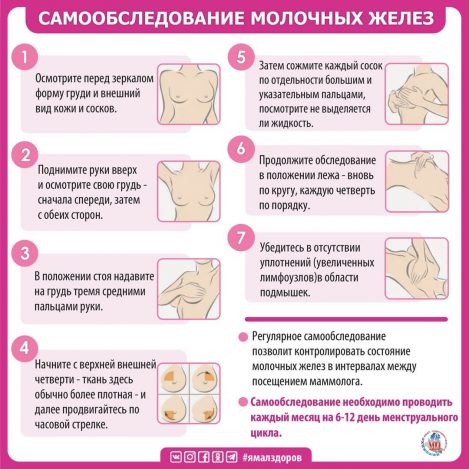
Здесь важна регулярность самоосмотра или самообследования молочных желёз.
Каждая женщина или мужчина из группы высокого риска (об этих группах речь несколько ниже) должна выполнять ежемесячное самообследование молочной железы. Для женщин с сохранённой менструацией следует проводить его на 7-10день менструального цикла (подсчёт с первого дня менструации), для женщин в менопаузе и постменопаузе достаточно выделить любое число месяца.
Проводить самообследование необходимо в комфортных для себя условиях и в спокойном состоянии.
Вначале следует осмотреть внутреннюю поверхность бюстгальтера или белья на предмет выделений. Затем посмотреться в зеркало и оценить форму, цвет и симметричность груди, оценить не отмечается ли фиксация или смещение одной из молочных желёз в сторону, сжать соски и проверить наличие выделений из них.
Далее, это удобнее делать в душе, можно приступать к методике самообследования «самоощупывания» груди.
Обратите внимание, что обследование левой молочной железы проводится правой рукой, а правой – левой рукой. Ощупывание следует проводить подушечками 2,3 или 2-4 пальцев, а не их кончиками, круговыми проникающими движениями. Большой палец при этом не участвует.
Здесь есть несколько подходов, можно выбрать тот, что нравится именно Вам.
В любом случае руку на стороне той груди, которую будете ощупывать, следует положить за голову.
Далее можно разделить железу на 4 квадрата по линиям проходящим через сосок : на верхние/нижние/наружные/внутренние и последовательно ощупывать одинаковые квадраты разных желёз по очереди, сравнивая их структуру с противоположной стороной или же можно двигаться по спирали по направлению к соску. Важно ощупать пространство под соском, т.к. это зона у женщин чувствительна, часто этот шаг пропускается, им не стоит пренебрегать. Не забудьте ощупать подмышку на предмет уплотнений.
Часто выявленные изменения имеют доброкачественное происхождение, их своевременное выявление позволяет предотвратить развитие рака груди.
Однако если вас стойко что-то встревожило следует немедленно обратиться к врачу маммологу или гинекологу, сообщить о своих тревогах.
Оцените наличие/отсутствие факторов повышенного риска развития рака молочной железы
К наиболее значимым факторам повышенного риска развития рака груди относят:
При наличии каких-либо из этих факторов риска следует обратиться к врачу который поможет более точно определить вероятностные группы риска(низкий/умеренный/высокий) и разработать/ обсудить дальнейшую стратегию наблюдения за состоянием Вашей груди, также рекомендуется посетить школу репродуктивного здоровья для большей информированности.
К какому врачу обращаться?
При первичном обращении или при мастопатиях можно выбрать: предпочтительнее маммолога или же гинеколога.
При диагнозе узлового образования в груди или после лечения рака молочной железы для мониторинга рецидива — к онкомаммологу.
Врач – маммолог более профессионально сможет оценить состояние вашей груди, оценить наличие или отсутствие повышенных факторов риска развития рака груди, обсудить возраст начала профилактического обследования (в некоторых случаях существуют определённые предпочтения), при необходимости дать направление на генетическое тестирование.
Изменение режима питания, коррекция веса
Научные изыскания подтвердили, что в обычных фруктах и овощах содержаться вещества, способные снизить образования в женском организме потенциального опасного метаболита С-16.
Рационально выстроенный пищевой рацион способен снизить риск возникновения или рецидива опухолевого процесса.
Подробнее выбрать индивидуальную программу можно с врачом –диетологом/нутрициологом.
Строго следить за весом, стараясь поддерживать его на оптимальном соответствующем вашему росту, телосложению и возрасту уровне.
Истощение также вредно Вашему организму!
Общие рекомендации:
Носите удобное белье, которое не травмирует\деформирует грудь, следите за весом, занимайтесь физической активностью, высыпайтесь, больше радуйтесь, помните гормоны удовольствия опосредованно укрепляют противоопухолевую защиту организма.
При наличии высоких факторов повышенного риска развития рака груди, информируйте о них гинеколога, в случае обсуждения возможностей гормональной контрацепции-это может повлиять на выбор препарата.
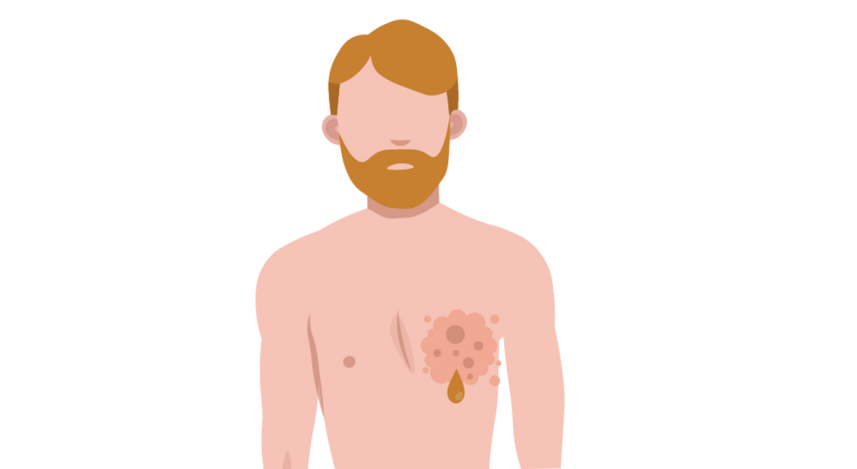
Какова вероятность того, что у мужчины разовьётся рак молочной железы?
По оценкам исследователей, рак молочной железы у мужчин составляет примерно 1 процент всех диагнозов РМЖ в год на планете.
Большинство мужчин вообще не знают, что такое возможно, легкомысленно считая проблемы с молочной железой уделом женщин. Мужчины часто не обращают внимание на уплотнение в груди, нагрубание молочных желёз (гинекомастию) и приходят на запущенных стадиях патологического процесса. Основные проявления заболевания схожи с таковыми у женщин.
Как и женщины, мужчины могут быть предрасположены к этому заболеванию генетически, если у них есть наследственная мутация гена BRCA1 или BRCA2 от одного из родителей, к факторам риска относят приём гормональных препаратов, возрастное снижение тестостерона в крови.
Злоупотребление алкоголем, резкое уменьшение физических нагрузок у спортсменов и увеличение стрессовых ситуаций, различные эндокринопатии: синдром Клайнфельтера, синдром Рейфенштейна, гипотиреоз, тестикулярная феминизация, опухоли надпочечников, гипофиза, яичек.
При выявлении факторов риска или появлении симптомов болезни следует обратиться к врачу маммологу, выполнить УЗИ, МРТ с в\в контрастированием данной области.