Репродуктивная токсичность что это
Репродуктивная токсичность
Несмотря на то, что многие пациенты до сих пор считают все лекарства невероятно вредными, способными оказывать токсическое влияние на различные органы, это совсем не так. Все препараты, прежде чем попасть в аптеки, тщательно проверяются и исследуются, чтобы исключить опасное воздействие на организм человека. Безусловно, есть список лекарств, которые имеют достаточно серьезные побочные эффекты, однако показания к их применению строго ограничены, и применяются они лишь при очень серьезных заболеваниях.
Борьба за репродуктивное здоровье
Одним из важных аспектов, который попадает под внимание подобных доклинических исследований, является репродуктивная токсичность препарата. Под этим термином подразумевается способность вещества оказывать токсическое воздействие на репродуктивные органы мужчины или женщины с последующим снижением половой функции и способности к размножению, а также патологическое воздействие на развитие потомства.
Чтобы исключить подобные нежелательные патологии, проводятся необходимые доклинические исследования репродуктивной токсичности препаратов. Для этого проводятся эксперименты на различных животных, таких как:
Такая работа позволяет определить репродуктивную токсичность препарата, что в дальнейшем даст возможность предотвратить развитие бесплодия у пациентов, а также негативное влияние на плод, с последующим влиянием на новорожденного ребенка в случае применения лекарственного средства во время беременности. В результате, если репродуктивная токсичность вещества превышает допустимые нормы, такой препарат будет отправлен на усовершенствование или же будет снят с производства на этапе доклинического исследования. Также возможен поиск такой дозы, при которой сохраняется необходимый терапевтический эффект, а репродуктивная токсичность остается на приемлемом уровне.
Изучение репродуктивной токсичности лекарственных средств в соответствии с Руководством по проведению доклинических исследований лекарственных средств. Под ред. Миронова А.Н., Бунатян Н.Д. и др. М., ЗАО «Гриф и К», 2012, FDA – Integration of Study Results to Assess Concerns about Human Reproductive and Developmental Toxicities, ICH – S5(R2);
Оценка генеративной токсичности, эмбрио- и фетотоксичности по показателям: предимплантационная смертность (эмбриотоксическое действие) и постимплантационная смертность (фетотоксическое действие) с оценкой тератогенного действия:
Репродуктивная токсичность что это
В последнее время наблюдается увеличение числа сосудистых заболеваний и цереброваскулярных нарушений центральной нервной системы. В лечении данных патологий важная роль принадлежит церебропротекторным, ноотропным и стресс-протекторным препаратам.
Исследования показали, что активный фармакологический ингредиент препарата «Лизаргам» (Nα-ацетил-D-лизил-лизил-аргинил-аргинил-амид) обладает нейропротекторным действием [1]. Введение препарата нормализует уровни цитокинов в головном мозге, а также обладает антиапоптотическим действием, поскольку может ограничивать развитие апоптоза в головном мозге после воздействия оксида углерода. Защитное действие исследуемого пептида характеризуется также нейротрофическим компонентом. Таким образом, препарат «Лизаргам» обладает высокой нейропротекторной эффективностью in vivo.
Материалы и методы исследования
В данной работе использовали готовую лекарственную форму (ГЛФ) «Лизаргам, спрей назальный дозированный 0,5% и 1,0%». Подробная характеристика ГЛФ приведена нами ранее [2]. Терапевтическую дозу препарата для человека (20 мкг/кг) высчитывали в соответствии с руководством Т.А. Гуськовой [2; 3].
Животные содержались в виварии согласно санитарно-эпидемиологическим требованиям от 29.08.2014 г., условия соответствовали Европейской конвенции по защите позвоночных животных (Страсбург, 1986 г.). Эксперименты проводились с разрешения биоэтической комиссии института. В качестве контроля во всех экспериментах использовали физиологический раствор (стерильный 0,9% раствор хлорида натрия, ФР).
Оценку репродуктивной токсичности (генеративной функции) проводили на белых беспородных крысах обоего пола (180-200 г, 9-10 недель) [4; 5]. Препарат «Лизаргам» вводили самкам (n=20) ежедневно интраназально (и/н) в дозе 5 мг/кг (максимальная доза, использованная в эксперименте по изучению хронической токсичности) в течение 15 дней (3 эстральных цикла). Самцам препарат вводили (n=10) и/н в дозе 5 мг/кг в течение всего периода сперматогенеза (48 дней). После введения препарата самок помещали с самцами на 2 эстральных цикла (10 дней). Взвешивание крыс проводили до начала эксперимента (фоновые значения), после завершения введения препарата и перед эвтаназией (самки). Забой и морфологическое исследование репродуктивной системы самок проводили на 20-й день после оплодотворения. Состояние внутренних органов и костной системы плодов исследовали по методу Вильсона или по модифицированному методу Даусона [4].
При изучении генотоксичности руководствовались рекомендациями действующих методических документов [4; 8]. Мутагенные свойства препарата «Лизаргам» изучали in vitro с использованием чашечного метода учета мутаций в тесте Эймса.
Проводили изучение индукции доминантных летальных мутаций в зародышевых клетках мышей (CBA x С57В1). В опытной и контрольной группах было по 15 самцов. В опытной группе «Лизаргам» вводили и/н в дозе 6 мг/кг однократно. К каждому самцу подсаживали по 3 интактных виргинных самки, затем заменяли новыми через 7 дней. На 15-17-й день беременности после эвтаназии самок вскрывали. Уровень постимплантационных потерь (А) подсчитывали по формуле:
Статистическую обработку проводили в программе Microsoft Excel-2007. Полученные данные представляли в виде средних значении и ошибок среднего (M±m). Различия между группами оценивали с помощью Т-критерия Стьюдента, а также теста Манна-Уитни.
Результаты исследования и их обсуждение
1. Оценка репродуктивной токсичности
1.1. Генеративная функция
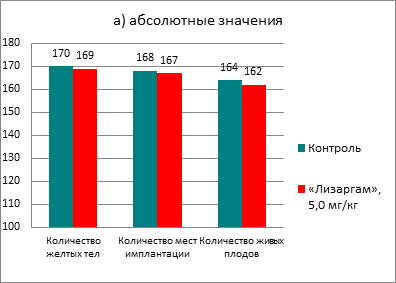
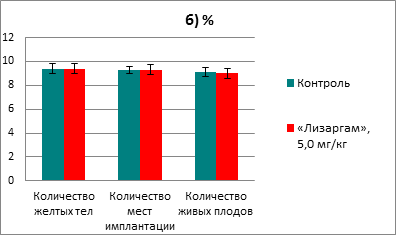
После введения препарата ни в одной из групп не наблюдалось гибели крыс. Не происходило снижение прироста массы тела, а также не было выявлено изменений в поведении животных. При изучении репродуктивной системы у самок не было обнаружено никаких патологических изменений. В каждой из групп было по 18 беременных самок, при этом индекс фертильности составил 90% и в опытной, и в контрольной группе. Результаты оценки параметров репродуктивной системы самок приведены на рисунке 1.
Рис. 1. Влияние препарата «Лизаргам» на параметры репродуктивной системы самок крыс
1.2. Изучение возможного эмбриотоксического действия
На первом этапе проводили оценку возможного действия препарата в пренатальный период развития. При и/н введении препарата самкам в дозах 1 и 5 мг/кг в течение 19 дней в репродуктивной системе самок не было обнаружено патологических изменений. Также не было выявлено нарушений в состоянии плодов.
На втором этапе изучали возможное постнатальное действие препарата. Результаты показали, что после введения препарата крысам не было обнаружено патологических изменений в развитии их потомства. Оценка количественных показателей, параметров физического развития, сроков формирования сенсорно-двигательных рефлексов и эмоционально-двигательного поведения неполовозрелого потомства самок крыс, получавших «Лизаргам», не выявила различий между контрольными и опытными группами (таблицы 1-3, рисунки 2, 3).
Количественные показатели потомства, рожденного от самок крыс, получавших препарат «Лизаргам»
Репродуктивная токсичность что это
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
РУКОВОДСТВО ПО ПРИМЕНЕНИЮ КРИТЕРИЕВ КЛАССИФИКАЦИИ ОПАСНОСТИ ХИМИЧЕСКОЙ ПРОДУКЦИИ ПО ВОЗДЕЙСТВИЮ НА ОРГАНИЗМ
Guidance on the application of the criteria of chemicals classification for health hazard. Reproductive toxicity
Дата введения 2018-01-01
Предисловие
1 РАЗРАБОТАН Техническим комитетом по стандартизации ТК 339 «Химическая безопасность веществ и материалов»
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
4 В настоящем стандарте реализованы положения международного документа «Руководство по применению критериев CLP. Руководство к Регламенту (ЕС) N 1272/2008* по классификации, маркировке и упаковке (CLP) веществ и смесей, версия 4.1, июнь 2015» (Guidance on the Application of the CLP Criteria, Guidance to Regulation (EC) N 1272/2008 on classification, labelling and packaging (CLP) of substances and mixtures, Version 4.1, June 2015)
6 ПЕРЕИЗДАНИЕ. Июль 2019 г.
1 Область применения
Настоящий стандарт содержит руководящие принципы по выбору наиболее подходящих данных и применению критериев классификации опасности химической продукции, воздействующей на функцию воспроизводства.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 32378 Методы испытания по воздействию химической продукции на организм человека. Испытания по оценке репродуктивной токсичности одного поколения
ГОСТ 32380 Методы испытания по воздействию химической продукции на организм человека. Испытания по оценке токсического воздействия на пренатальное развитие
ГОСТ 32419 Классификация опасности химической продукции. Общие требования
ГОСТ 32423-2013 Классификация опасности смесевой химической продукции по воздействию на организм
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 гонадотропное действие (gonadotropic action): Вредное воздействие химической продукции на половые железы и систему их регуляции.
3.2 испытания in vitro (in vitro test): Испытания, при проведении которых в качестве тест-систем используют не многоклеточные целостные организмы, а микроорганизмы или ткани, изолированные от целостного организма, или их модели.
3.3 испытания in vivo (in vivo test): Испытания, при проведении которых в качестве тест-систем используют живую ткань при живом организме. Клинические испытания и исследования на животных являются формами испытаний in vivo.
3.4 тератогенное действие (teratogenic action): Вредное воздействие химической продукции на зародыш с возникновением структурных и функциональных аномалий и пороков развития.
3.5 химическая продукция, воздействующая на функцию воспроизводства (репродуктивную функцию) (reproductive toxicants): Химическая продукция, обладающая тератогенным, гонадотропным или эмбриотропным действием.
3.6 эмбриотропное действие (embryotrophic action): Вредное воздействие химической продукции, вызывающее внутриутробную гибель эмбрионов, снижение массы и размеров эмбрионов при нормальной дифференцировке тканей.
4 Классификация опасности химической продукции, воздействующей на функцию воспроизводства
4.1 Репродуктивная токсичность включает вредное воздействие на половую функцию и репродуктивность взрослых мужчин и женщин, а также на развитие потомства.
4.2 Проявления вредного воздействия на половую функцию и репродуктивность могут включать изменения в женской и мужской репродуктивной системе, а также отрицательное воздействие на следующие показатели:
— начало процесса полового созревания;
— производство и перенос зародышевых клеток;
— нормальное течение репродуктивного цикла;
— нормальное репродуктивное старение;
— другие функции, которые зависят от целостности репродуктивных систем.
4.3 Проявления вредного воздействия на процесс развития потомства могут включать:
4.4 Критерии классификации опасности химической продукции, воздействующей на функцию воспроизводства, установлены в ГОСТ 32419 и ГОСТ 32423.
4.5 Химическую продукцию, воздействующую на функцию воспроизводства, относят к одному из двух классов опасности в соответствии с таблицей 1.
Критерий определения класса опасности химической продукции
Достаточные доказательства вредного воздействия на функцию воспроизводства человека, приведенные в эпидемиологических исследованиях
Ограниченные доказательства вредного воздействия на функцию воспроизводства человека в сочетании с достаточными доказательствами вредного воздействия на функцию воспроизводства животных
Ограниченные доказательства вредного воздействия на функцию воспроизводства человека и/или животных, которые являются недостаточно убедительными для отнесения данной химической продукции к классу 1
Химическая продукция, оказывающая воздействие на лактацию или через нее
Существующая вероятность присутствия вещества на потенциально токсичных уровнях в грудном молоке, обнаруженная в результате исследований абсорбции, метаболизма, распределения и выделения;
свидетельство вредного воздействия на потомство в связи с переносом в молоке или на качество молока, полученного в результате исследований на одном или двух поколениях животных;
данные о воздействии на человека, указывающие на опасность для детей в течение периода грудного вскармливания
4.6 Химическая продукция, оказывающая воздействие на лактацию или через нее, вынесена в отдельный класс в целях надлежащего доведения информации о данном виде опасности до кормящих матерей.
4.7 Критерии применимы для классификации опасности как индивидуальных химических веществ, так и смесевой химической продукции в случае наличия данных по смеси в целом.
4.8 Отнесение химической продукции к воздействующей на функцию воспроизводства класса 1А основано на данных о воздействии на людей.
4.9 Отнесение химической продукции к воздействующей на функцию воспроизводства класса 1В в значительной степени основано на результатах испытаний на животных, которые обеспечивают четкие доказательства вредного воздействия на половую функцию и репродуктивность или на развитие потомства в отсутствие другого токсического воздействия.
4.10 Если существует информация о механизме воздействия на подопытных животных, которая вызывает сомнения относительно его действенности на человека, то предпочтительным является отнесение химической продукции к воздействующей на функцию воспроизводства класса 2.
4.11 Отнесение химической продукции к воздействующей на функцию воспроизводства класса 2 основано на имеющихся доказательствах, полученных в результате наблюдения над людьми или испытаний на животных и, возможно, дополненных другой информацией о вредном воздействии на половую функцию и репродуктивность или на развитие потомства в отсутствие другого токсического воздействия.
5 Классификация опасности смесевой химической продукции, воздействующей на функцию воспроизводства
5.1 Общие принципы классификации опасности смесевой химической продукции
5.1.1 Общие принципы классификации опасности смесевой химической продукции, в том числе воздействующей на функцию воспроизводства, установлены в разделе 4 ГОСТ 32423-2013.
5.1.2 Критерии классификации опасности смесевой химической продукции в отношении воздействия на функцию воспроизводства при наличии экспериментальных данных по смеси в целом представлены в таблице 1.
5.1.3 При отсутствии экспериментальных данных по смеси в целом используют принципы интерполяции, изложенные в разделе 6 ГОСТ 32423-2013, за исключением принципа увеличения концентрации компонентов смеси, отнесенных к более высокому классу опасности, и интерполяции внутри одного класса опасности.
5.1.4 В случае отсутствия экспериментальных данных по смеси в целом и информации, которая позволила бы использовать применимые принципы интерполяции, для классификации применяют методы оценки опасности на основе известной информации по отдельным компонентам смеси.
5.2 Расчетный метод классификации опасности смесевой химической продукции, воздействующей на функцию воспроизводства
5.2.1 Смесь классифицируют в качестве химической продукции, воздействующей на функцию воспроизводства, если она содержит хотя бы один компонент, обладающий данным видом опасности, в концентрации, равной или превышающей пределы, указанные в таблице 2.
Класс опасности компонентов, отнесенных к химической продукции, воздействующей на функцию воспроизводства
Суммарная концентрация компонентов С, %, позволяющая отнести смесь к следующим классам опасности химической продукции, воздействующей на функцию воспроизводства
Химическая продукция, оказывающая воздействие на лактацию или через нее
Репродуктивная токсичность что это
 |  |

 Фундаментальные исследования
Фундаментальные исследования