Регресс зубца r что это
Регресс зубца r что это
Чаще всего причинами резкого изменения рисунка комплекса QRS являются: (1) формирование соединительнотканного рубца на месте бывшего инфаркта миокарда; (2) многочисленные нарушения проведения импульсов в различных участках системы Пуркинье. В результате проведение импульса становится беспорядочным, возникают быстрые изменения величины потенциалов и направления электрической оси сердца. Часто появляется удвоение и даже утроение зубца R желудочкового комплекса в некоторых отведениях.
Токи повреждения. Многочисленные причины, особенно такие, как повреждение сердечной мышцы, приводят к формированию очага, постоянно деполяризованного (частично или полностью). Если это случается, между патологически деполяризованным очагом и остальным миокардом возникают токи, которые сохраняется постоянно, даже в промежутке между сердечными циклами. Эти токи называют токами повреждения. Важно запомнить, что поврежденный участок миокарда является электроотрицательным, тогда как остальной миокард — электронейтральным или электроположительным.
Причинами повреждения могут быть: (1) механическая травма, приводящая к увеличению проницаемости клеточных мембран, вследствие этого полная реполяризация становится невозможной; (2) инфекционные процессы, вызывающие повреждение мембран; (3) ишемия отдельных участков миокарда, вызванная закупоркой коронарных артерий, которая и является главной причиной формирования токов повреждения в сердце. Дело в том, что снижение коронарного кровотока и недостаточное снабжение кардиомиоцитов питательными веществами приводит к нарушению механизмов, поддерживающих нормальный уровень мембранных потенциалов.
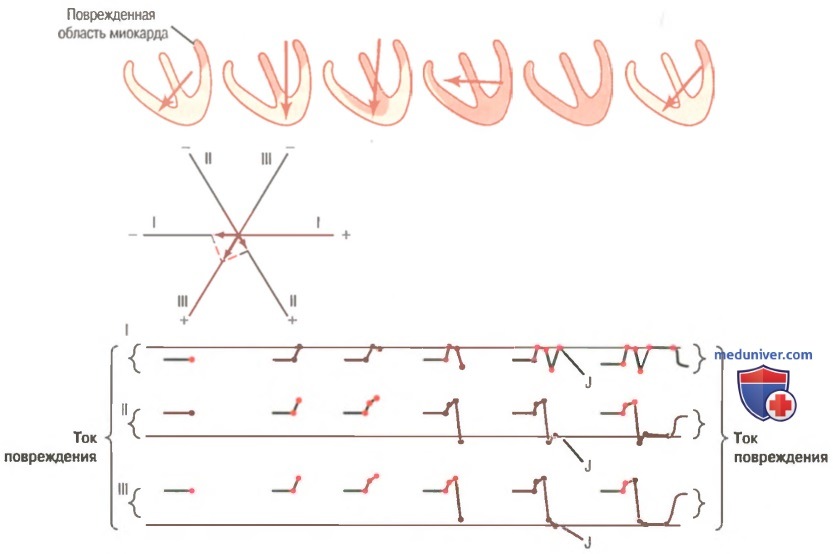
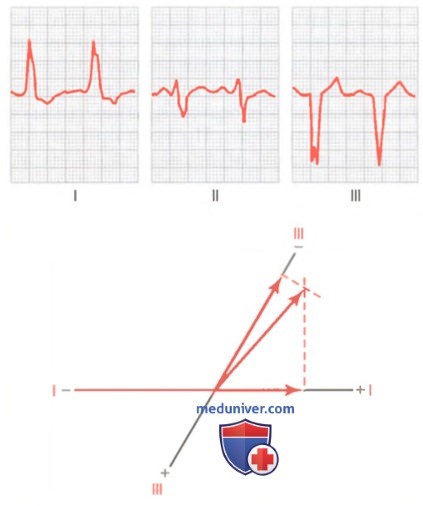
Влияние токов повреждения на комплекс QRS. На рисунке в небольшом участке миокарда у основания левого желудочка возник инфаркт вследствие острого нарушения коронарного кровотока. В результате во время интервала Т-Р, когда желудочки обычно находятся в состоянии электрического покоя, между инфарктной зоной и остальной массой миокарда циркулируют аномальные токи. Вектор этих токов повреждения, как показано на первой схеме сердца на рисунке, имеет направление +125°, т.е. от основания левого желудочка вправо («минус») и вниз («плюс»). Ниже схемы сердца показана проекция этого вектора на оси трех стандартных отведений.
Видно, что еще до начала желудочкового комплекса QRS в отведении I регистрируется смещение вниз от нулевой линии, т.к. проекция вектора направлена к отрицательному полюсу оси отведения I. В отведении II регистрируется смещение вверх от нулевой линии, т.к. проекция вектора направлена к положительному полюсу оси отведения П. В отведении III регистрируется также положительное смещение. Оно имеет большую величину, чем в отведениях I и II, потому что направление вектора совпадает с направлением оси отведения III.
Когда в желудочках начинается обычный процесс деполяризации, первой деполяризуется межжелудочковая перегородка; затем деполяризация распространяется на верхушку сердца, а от верхушки — к основанию желудочков. Участком миокарда, который деполяризуется в последнюю очередь, оказывается основание правого желудочка (поскольку основание левого желудочка постоянно деполяризовано). Последовательность формирования электрокардиограммы, отражающей процесс деполяризации желудочков, может быть воспроизведена графически.
Когда желудочки сердца оказываются полностью деполяризованными, разность потенциалов в миокарде (и на электрокардиографических электродах) отсутствует, т.к. и поврежденный участок миокарда, и остальная масса миокарда электроотрицательны.
В результате реполяризуются все отделы сердца, кроме постоянно деполяризованной инфарктной зоны у основания левого желудочка. Таким образом, во всех трех стандартных отведениях опять проявляются токи повреждения.
Учебное видео оценки комплекса QRS на ЭКГ в норме и при патологии
— Вернуться в оглавление раздела «Физиология человека.»
Регресс зубца r что это
Медленный прирост зубца R как неспецифический показатель часто наблюдается при ГЛЖ и при острой или хронической перегрузке ПЖ. Зубцы Q в такой ситуации могут отражать различные механизмы, включая изменение в балансе электродвижущих сил ранней деполяризации желудочков и измененной геометрии сердца, а также его положения. Выраженная потеря амплитуды зубца R, иногда с явными зубцами Q в отведениях от V1 до боковых трудных, может наблюдаться при ХОБЛ.
Наличие низкоамплитудных зубцов в отведениях от конечностей и признаки нарушения функции ПП (P-pulmonale) могут служить дополнительным диагностическим признаком. Эта потеря прироста зубца R может отчасти отражать дилатацию ПЖ. Кроме того, смещение сердца вниз в эмфизематозно измененной трудной клетке может стать причиной недостаточного прироста зубца R при этой патологии. Частичной или полной нормализации зубца R можно достичь простим смещением электродом на одно межреберное пространство ниже их обычного положения.
Различные псевдоинфарктные признаки возможны при остром легочном сердце, вызванном легочной эмболией. Острая перегрузка ПЖ в этой ситуации можетстать причиной медленного прироста зубца R и инверсии зубца Т от правых до средних грудных отведений (ранее такие изменения па ЭКГ называли «перегрузкой» ПЖ), симулируя переднюю ишемию или ИМ. Классическая конфигурация S1Q3T3 возможна, но она не является ни чувствительной, ни специфичной. Дополнительно можно выявить глубокие зубцы Q (обычно как часть комплекса QR) в отведении aVF.
Однако острая правая перегрузка сама по себе не вызывает аномальные зубцы Q в отведении II. Перегрузка правых отделов сердца, острая или хроническая, также может быть связана с комплексом QR в отведении V1 и симулировать переднеперегородочпый ИМ.
Псевдоинфарктные признаки часто наблюдаются у больных с ГКМП, а их ЭКГ может симулировать передний, нижний, задний или боковой ИМ. Патогенез нарушений деполяризации при этом виде КМИ неясен. Глубокие нижнебоковые зубцы Q (II, III, aVF и V4-V6) и высокие зубцы R в правых грудных отведениях, вероятно, связаны с увеличенными электродвижущими силами деполяризации, образованными сильно гипертрофированной МЖП. Нарушенная деполяризация перегородки также может вносить вклад в появление необычных комплексов QRS.
Потеря электродвижущих сил в результате некроза миокарда приводит к потере зубца R и образованию зубца Q в случаях ИМ. Однако этот механизм патогенеза зубца Q не является специфичным для заболевания КА у больных ИМ. Любой процесс, острый или хронический, который ведет к значительной потере локальных электродвижущих потенциалов, может в результате привести к образованию зубцов Q. Например, замена части миокарда на электрически нейтральные ткани, такие как амилоид пли новообразования, может стать причиной появления неинфарктных зубцов Q.
Для различных дилатациопных КМП, связанных с разрастанием в миокарде фиброзных волокон, характерны псевдоинфарктные признаки. Гипертрофия желудочков в этих случаях также может вносить свой вклад в патогенез зубца Q. Таким образом, зубцы Q, появившиеся в связи с повреждением миокарда (ишемической или неишемической природы), могут быть кратковременны и не обязательно указывать на необратимое повреждение сердечной мышцы. Тяжелая ишемия может сопровождаться локальной потерей электродвижущих потенциалов без фактической гибели клетки (феномен «электрического оглушения»). Преходящие нарушения проводимости также могут вызвать изменения в возбуждении желудочков и стать причиной появления неинфарктных зубцов Q.
В некоторых случаях преходящие зубцы Q могут указывать на реальный первичный Q-образующий ИМ. Новые непреходящие зубцы Q были описаны у больных с тяжелой АГ различного генеза, а также у больных с тахиаритмиями, миокардитами, стенокардией Prinzmetal, длительной гипогликемией, фосфорной интоксикацией и гиперкалиемией.
Возможности оценки регресса гипертензионных изменений левого желудочка на фоне медикаментозной терапии артериальной гипертензии при помощи усредненной
Проведено сравнение эффективности эхокардиографии (ЭхоКГ), традиционной и усредненной электрокардиографии (ЭКГ) по контролю гипертензионных изменений левого желудочка сердца на фоне терапии артериальной гипертензии. Установлено, что метод ЭКГ высокого раз
The ability of 12-lead averaged electrocardiography (ECG) versus conventional ECG and echocardiography to determine left ventricular hypertensive changes during treatment of arterial hypertension were compared. Averaged ECG was defined to be effective and to excel conventional ECG and echocardiography in determining minor changes of LVH parameters during short-term medical treatment of arterial hypertension.
Артериальная гипертензия (АГ) представляет собой важную медико-социальную проблему, что объясняется высокой распространенностью данного заболевания в структуре хронических неинфекционных заболеваний и значительным увеличением риска развития сердечно-сосудистых осложнений [1]. На сегодняшний день очевидно, что неблагоприятная значимость АГ определяется не только степенью увеличения артериального давления (АД), но и вовлеченностью в патологический процесс органов-мишеней [2].
Характерным признаком формирования гипертонического сердца является развитие гипертрофии левого желудочка (ГЛЖ), которая признана независимым предиктором неблагоприятных кардиоваскулярных событий [3, 4]. В то же время доказано, что ГЛЖ является потенциально обратимым состоянием, при этом регресс изменений в миокарде левого желудочка сопровождается существенным снижением сердечно-сосудистой заболеваемости и смертности вне зависимости от степени снижения АД [5, 6].
Прогностическая значимость и возможность обратного развития ГЛЖ позволили определить новый подход к оценке эффективности терапии АГ, которая определяется не только антигипертензивными свойствами лекарственных препаратов, но и их органопротективным потенциалом [2]. Результаты большинства сравнительных исследований свидетельствуют о том, что из всех используемых для лечения АГ классов препаратов наиболее эффективными в отношении обратного развития ГЛЖ являются антагонисты кальция (АК), ингибиторы ангиотензинпревращающего фермента (иАПФ) и антагонисты рецепторов ангиотензина (АРА) [8, 9].
Таким образом, актуальным является поиск наиболее эффективного способа динамического контроля ГЛЖ. С этой целью в настоящее время используются электрокардиография (ЭКГ) и эхокардиография (ЭхоКГ). Оба метода имеют определенные недостатки, которые могут приводить к существенной изменчивости показателей, отражающих изменения миокарда левого желудочка, что затрудняет интерпретацию данных при повторных исследованиях, особенно при небольшой величине изменений.
Существует метод усредненной ЭКГ, который позволяет устранить ряд недостатков традиционного способа регистрации кардиосигнала [10]. В проведенных нами ранее исследованиях усреднение ЭКГ позволило повысить воспроизводимость отдельных амплитудных и временных показателей, а также индексов ГЛЖ в сравнении с традиционным способом в 1,5–3 раза при снятии электродов с грудной клетки между исследованиями и в 2–10 раз при отсутствии смещения электродов при повторной регистрации ЭКГ [11, 12]. Полученные данные позволили предположить, что метод усредненной ЭКГ потенциально может быть более надежным при динамическом контроле ГЛЖ, чем традиционные способы диагностики.
Учитывая приведенные положения, цель настоящего исследования заключалась в сравнительной оценке эффективности усредненной ЭКГ, традиционной ЭКГ и ЭхоКГ по оценке динамики гипертензионных изменений левого желудочка сердца на фоне антигипертензивной терапии.
Материалы и методы исследования
Исследование проводилось в группе больных эссенциальной АГ I–II стадии с повышением АД 1–3 степени в возрасте от 35 до 65 лет (n = 80). На момент включения все пациенты не получали эффективной антигипертензивной терапии. На этапе скрининга из исследования исключались пациенты с вторичными формами АГ, выраженными проявлениями атеросклероза любой локализации, наличием указаний в анамнезе на перенесенный инфаркт миокарда или инсульт, тяжелой сопутствующей патологией, требующей постоянной терапии и способной повлиять на результаты исследования, наличием противопоказаний к назначению используемых в исследовании лекарственных препаратов. Из исследования также исключались пациенты при наличии фибрилляции предсердий и тяжелых нарушений ритма сердца.
В соответствии с протоколом исследования первичное обследование включало оценку антропометрических показателей (вес и рост с расчетом ИМТ по формуле Кетле), измерение АД, регистрация ЭКГ в 12 общепринятых отведениях и эхокардиографическое обследование. Обследование проводилось перед назначением антигипертензивного препарата, а также по окончании периода наблюдения. Дополнительная оценка антропометрических, гемодинамических и электрокардиографических показателей выполнялась во время промежуточных визитов через 2 недели и 1 месяц от начала терапии.
Регистрация ЭКГ в 12 общепринятых отведениях в течение 5 минут выполнялась с соблюдением общих правил после 10 минут отдыха в положении пациента на спине. Для определения положения электродов использовались стандартные анатомические ориентиры. Для записи кардиосигнала использовался компьютеризированный электрокардиограф ЭК9 Ц-01-КАРД и оригинальная компьютерная программа HR ECG. Блок обработки программы позволяет выполнять усреднение зарегистрированного кардиосигнала, а также автоматически расставлять метки начала и окончания зубцов усредненного и неусредненного кардиоцикла с функцией ручной коррекции их положения и вывода амплитудно-временных характеристик зубцов и интервалов. Показатели ЭКГ использовались в дальнейшем для оценки традиционных индексов ГЛЖ (Соколова–Лайона, Корнельского вольтажного индекса, Корнельского произведения), а также расчета массы миокарда левого желудочка по разработанной ранее формуле [13, 14]:
где ММЛЖ — масса миокарда левого желудочка сердца (граммы); возраст — возраст пациента (годы); пол — пол пациента (0 — мужчины, 1 — женщины); ИМТ — индекс массы тела (кг/м 2 ); Pd — максимальная продолжительность зубца P (секунды); RAVL — амплитуда зубца R в отведении AVL (мВ); SV3 — амплитуда зубца S в отведении V3 (мВ); TV1 — амплитуда зубца Т в отведении V1 (мВ); TV6 — амплитуда зубца Т в отведении V6 (мВ).
Эхокардиографическое исследование проводилось по стандартному протоколу с целью исключения нарушений систолической функции левого желудочка, выраженных нарушений гемодинамики, а также оценки ММЛЖ на ультразвуковом аппарате экспертного класса VIVID 9 (General Electric, США) с использованием одномерного, двухмерного и допплеровского режимов сканирования. ММЛЖ рассчитывалась по формуле, рекомендованной ASE [15]:
где КДР — конечный диастолический размер левого желудочка; ТЗСд — толщина задней стенки левого желудочка в диастолу; ТМЖПд — толщина межжелудочковой перегородки в диастолу.
После первичного обследования пациенты случайным образом распределялись в группы в зависимости от назначаемой терапии. Для медикаментозной терапии использовались следующие антигипертензивные препараты и режимы дозирования: периндоприл аргинин (Престариум А, Servier) в стартовой дозе 5 мг в сутки однократно (группа 1, n = 20), лозартан калия (Козаар, Merck Sharp & Dohme) в стартовой дозе 50 мг в сутки однократно (группа 2, n = 20), амлодипин безилат (Норваск, Phiser) в стартовой дозе 5 мг в сутки однократно (группа 3, n = 20), фиксированная комбинация периндоприла аргинина и амлодипина безилата (Престанс, Servier) в стартовой дозе 5/5 мг в сутки однократно (группа 4, n = 20).
Продолжительность периода наблюдения составила 3 месяца.
Обработка результатов исследования проводилась с помощью программы SPSS 13.00. Данные представлялись как среднее ± стандартное отклонение (М ± s) при сравнении исходных характеристик, а при оценке динамики показателей — как среднее ± доверительный интервал. Сравнение связанных выборок проводили при помощи парного t-теста Стьюдента. Для сравнения несвязанных выборок использовался анализ ANOVA. Связи между переменными оценивались при помощи корреляционного анализа Пирсона и множественной линейной регрессии.
На всех этапах статистического анализа нулевая гипотеза отвергалась при значениях р меньше 0,05.
Результаты
В ходе наблюдения из исследования выбыли 16 пациентов: из группы 1 — 4 человека (3 пациента отказались от продолжения терапии из-за развития нежелательных явлений — кашля (2 человека) и тошноты (1 человек), 1 — исключен из-за несоблюдения сроков плановых визитов); из группы 2 выбыли 3 человека (1 — из-за развития головокружения, 2 — в связи с несоблюдением плана визитов); из группы 3 — 5 человек (3 прекратили прием препарата из-за развития отеков на нижних конечностях, 1 исключен в связи с низкой приверженностью к терапии, 1 — в связи с несоблюдением плана визитов); из группы 4 — 4 участника (2 — из-за развития кашля, 1 — из-за появления отеков, 1 — из-за несоблюдения плана визитов). Таким образом, в статистическую обработку были включены данные наблюдения лиц, полностью завершивших протокол исследования (n = 64).
Исходные антропометрические и гемодинамические характеристики групп представлены в табл. 1. При сравнении групп достоверных различий не выявлено ни по одному из изучавшихся параметров (p > 0,05 для всех). Включенные в исследование лица были также сопоставимы по оцениваемым в исследовании электрокардиографическим критериям ГЛЖ и ММЛЖ, рассчитанной по данным ЭхоКГ, усредненной и традиционной ЭКГ (табл. 2, 3).
Значимое снижение АД отмечалось во всех группах уже через 2 недели от начала терапии и к концу периода наблюдения составило для САД –19,0 мм рт. ст., —19,2 мм рт. ст., –29,3 мм рт. ст., –31,6 мм рт. ст., для ДАД –9,8 мм рт. ст., –9,4 мм рт. ст., —14,6 мм рт. ст., –14,4 мм рт. ст. в группах 1, 2, 3, 4 соответственно. При попарном сравнении групп монотерапии (группы 1, 2 и 3) и комбинированного препарата (группа 4) были выявлены значимые различия по степени снижения САД между группой 4 и группами 1, 2 (р = 0,01 и р = 0,02 соответственно) и между группой 3 и группами 1, 2 (р = 0,03 и 0,049 соответственно). Динамика САД в группах 3 и 4 значимо не различалась (р = 0,65). Различий в отношении изменений ДАД выявлено не было (р = 0,15 по данным ANOVA). Частота сердечных сокращений значимо не изменялась ни в одной из групп.
Близкое к достоверному снижение Корнельского произведения в группе 3, а также всех оцениваемых в исследовании индексов ГЛЖ в группе 4 по данным усредненной ЭКГ отмечалось уже через 2 недели от начала терапии (табл. 4), а через 1 месяц регистрировались статистически значимые изменения Корнельского произведения во всех группах, а также остальных изучавшихся индексов ГЛЖ в группе 4 (табл. 5). Через 3 месяца терапии были получены значимые изменения всех оцениваемых в исследовании индексов ГЛЖ в каждой из групп.
Неусредненная ЭКГ, в свою очередь, позволила регистрировать значимое снижение отдельных индексов ГЛЖ, таких как Корнельский вольтаж и Корнельское произведение, во всех группах только через 3 месяца терапии, в то время как достоверного изменения индекса Соколова–Лайона на протяжении всего периода наблюдения не было выявлено ни в одной из групп (табл. 6).
По данным усредненной ЭКГ близкие к достоверным изменения массы миокарда (p
* ФГБОУ ВО ОмГМУ МЗ РФ, Омск
** ФГБУЗ ЗСМЦ ФМБА России, Омск
Возможности оценки регресса гипертензионных изменений левого желудочка на фоне медикаментозной терапии артериальной гипертензии при помощи усредненной ЭКГ в сравнении с традиционной ЭКГ и эхокардиографией/ О. И. Чиндарева, А. А. Семенкин, Н. В. Махрова, Г. И. Нечаева, Е. Н. Логинова
Для цитирования: Лечащий врач № 2/2018; Номера страниц в выпуске: 14-19
Теги: эхокардиография, электрокардиография, гипертензионные изменения, миокард
Удлинение интервала QT
Статья посвящена врождённому и приобретённому ЭКГ-синдрому удлинённого интервала QТ, а также Амиодарону, как наиболее частой медикаментозной причине данного состояния.
Синдром удлинения QT интервала представляет собой сочетание удлиненного интервала QT стандартной ЭКГ и угрожающих жизни полиморфных желудочковых тахикардий (torsade de pointes – «пируэт»). Пароксизмы желудочковых тахикардий типа «пируэт» клинически проявляются эпизодами потери сознания и нередко заканчиваются фибрилляцией желудочков, являющихся непосредственной причиной внезапной смерти.
Длительность интервала QT зависит от частоты сердечных сокращений и пола пациента. Поэтому используют не абсолютную, а корригированную величину интервала QT (QTc), которую рассчитывают по формуле Базетта:
где: RR – расстояние между соседними зубцами R на ЭКГ в сек. ;
К = 0, 37 для мужчин и К = 0, 40 для женщин.
Удлинение интервала QT диагностируют в том случае, если длительность QTc превышает 0, 44 с.
Установлено, что как врожденные, так и приобретенные формы удлинения интервала QT являются предикторами фатальных нарушений ритма, которые, в свою очередь, приводят к внезапной смерти больных.
Так, отсутствует единое мнение о верхней границе нормальных значениях дисперсии корригированного интервала QT. По мнению одних авторов, предиктором желудочковых тахиаритимий является QTcd более 45, другие исследователи предлагают считать верхней границей нормы QTcd 70 мс и даже 125 мс.
Cуществуют два наиболее изученных патогенетических механизма аритмий при синдроме удлиненного QT интервала. Первый – механизм «внутрисердечных нарушений» реполяризации миокарда, а именно, повышенная чувствительность миокарда к аритмогенному эффекту катехоламинов. Второй патофизиологический механизм – дисбаланс симпатической иннервации (снижение правосторонней симпатической иннервации вследствие слабости или недоразвития правого звездчатого ганглия). Эта концепция подтверждается на моделях с животными (удлинение QT интервала после правосторонней стеллэктомии) и результатами левосторонней стеллэктомии в лечении резистентных форм удлинения QT интервала.
Частота выявления удлинения интервала QT у лиц с пролапсами митрального и/или трикуспидального клапанов достигает 33%. По мнению большинства исследователей, пролапс митрального клапана является одним из проявлений врожденной дисплазии соединительной ткани. Среди других проявлений «слабости соединительной ткани» – повышенная растяжимость кожи, астенический тип телосложения, воронкообразная деформация грудной клетки, сколиоз, плоскостопие, синдром гипермобильности суставов, миопия, варикозное расширение вен, грыжи. Рядом исследователей выявлена взаимосвязь увеличенной варибельности QT интервала и глубины пролабирования и/или наличия структурных изменений (миксоматозная дегенерация) створок митрального клапана. Одной из главных причин формирования удлинения интервала QT у лиц с пролапсом митрального клапана является генетически предопределенный или приобретенный дефицит магния
Приобретенное удлинение QT интервала может возникнуть при атеросклеротическом или постинфарктном кардиосклерозе, при кардиомиопатии, на фоне и после перенесенного мио– или перикардита. Увеличение дисперсии интервала QT (более 47 мс) может также являться предиктором развития аритмогенных синкопальных состояний у больных с аортальными пороками сердца.
Удлинение интервала QT может наблюдаться и при синусовой брадикардии, атриовентрикулярной блокаде, хронической цереброваскулярной недостаточности и опухоли головного мозга. Острые случаи удлинения интервала QT могут также возникать при травмах (грудной клетки, черепно–мозговых).
Автономная нейропатия также увеличивает величину интервала QT и его дисперсию, поэтому данные синдромы имеют место у больных сахарным диабетом I и II типов.
Удлинение интервала QT может иметь место при нарушениях электролитного баланса с гипокалиемией, гипокальциемией, гипомагнезиемией. Подобные состояния возникают под воздействием многих причин, например, при длительном приеме диуретиков, особенно петлевых (фуросемид). Описано развитие желудочковой тахикардии типа «пируэт» на фоне удлинения интервала QT cо смертельным исходом у женщин, находившихся на малобелковой диете с целью снижения массы тела.
Общеизвестно удлинение QT при острой ишемии миокарда и инфаркте миокарда. Стойкое (более 5 дней) увеличение интервала QT, особенно при сочетании с ранними желудочковыми экстрасистолами, прогностически неблагоприятно. У этих пациентов выявлено значительное (в 5–6 раз) повышение риска внезапной смерти.
В патогенезе удлинения QT при остром инфаркте миокарда, несомненно, играет роль гиперсимпатикотония, именно этим многие авторы объясняют высокую эффективность b–блокаторов у этих пациентов. Кроме того, в основе развития данного синдрома лежат и электролитные нарушения, в частности, дефицит магния. Результаты многих исследований свидетельствуют о том, что до 90% больных с острым инфарктом миокарда имеют дефицит магния. Выявлена также обратная корреляционноая взаимосвязь уровня магния в крови (сыворотке и эритроцитах) с величиной интервала QT и его дисперсией у пациентов с острым инфарктом миокарда.
У пациентов с идиопатическим пролапсом митрального клапана лечение следует начинать с применения пероральных препаратов магния (Магнерот по 2 табл. 3 раза в день в течение не менее 6 месяцев), поскольку тканевой дефицит магния считают одним из основных патофизиологических механизмов формирования как синдрома удлинения QT интервала, так и «слабости» соединительной ткани. У этих лиц после лечения препаратами магния не только нормализуется величина интервала QT, но и уменьшаются глубина пролабирования створок митрального клапана, частота желудочковых экстрасистол, выраженность клинических проявлений (синдрома вегетативной дистонии, геморрагических симптомов и др. ). Если лечение пероральными препаратами магния через 6 месяцев не оказало полного эффекта показано добавление b–блокаторов.
Другой важной причной удлинёния интервала QT является приём специальных медикаментов, одним из таких препаратов, чаще всего используемых в клинической практике является Амиодарон (Кордарон).
Амиодарон относится к III классу антиаритмических препаратов (класс ингибиторов реполяризации) и обладает уникальным механизмом антиаритмического действия, так как помимо свойств антиаритмиков III класса (блокада калиевых каналов) он обладает эффектами антиаритмиков I класса (блокада натриевых каналов), антиаритмиков IV класса (блокада кальциевых каналов) и неконкурентным бета-блокирующим действием.
Кроме антиаритмического действия у него имеются антиангинальный, коронарорасширяющий, альфа- и бета-адреноблокирующий эффекты.
Антиаритмические свойства:
— увеличение продолжительности 3-ей фазы потенциала действия кардиомиоцитов, в основном за счет блокирования ионного тока в калиевых каналах (эффект антиаритмика III класса по классификации Вильямса) ;
— уменьшение автоматизма синусового узла, приводящее к уменьшению частоты сердечных сокращений;
— неконкурентная блокада альфа- и бета- адренергических рецепторов;
Описание
— замедление синоатриальной, предсердной и атриовентрикулярной проводимости, более выраженное при тахикардии;
— отсутствие изменений проводимости желудочков;
— увеличение рефрактерных периодов и уменьшение возбудимости миокарда предсердий и желудочков, а также увеличение рефрактерного периода атриовентрикулярного узла;
— замедление проведения и увеличение продолжительности рефрактерного периода в дополнительных пучках предсердно-желудочкового проведения.
Другие эффекты:
— отсутствие отрицательного инотропного действия при приеме внутрь;
— снижение потребления кислорода миокардом за счет умеренного снижения периферического сопротивления и частоты сердечных сокращений;
— увеличение коронарного кровотока за счет прямого воздействия на гладкую мускулатуру коронарных артерий;
— поддержания сердечного выброса за счет снижения давления в аорте и снижения периферического сопротивления;
— влияние на обмен тиреоидных гормонов: ингибирование превращения Тз в Т4 (блокада тироксин-5-дейодиназы) и блокирование захвата этих гормонов кардиоцитами и гепатоцитами, приводящее к ослаблению стимулирующего влияния тиреоидных гормонов на миокард.
Терапевтические эффекты наблюдаются в среднем через неделю после начала приема препарата (от нескольких дней до двух недель). После прекращения его приема амиодарон определяется в плазме крови на протяжении 9 месяцев. Следует принимать во внимание возможность сохранения фармакодинамического действия амиодарона в течение 10-30 дней после его отмены.
Каждая доза амиодарона (200 мг) содержит 75 мг йода.
Показания к применению
Профилактика внезапной аритмической смерти у больных группы высокого риска
Для больных хронической сердечной недостаточностью амиодарон является единственным разрешенным к применению антиаритмиком. Это связано с тем, что прочие препараты у этой категории пациентов или увеличивают риск внезапной середечной смерти, или угнетают гемодинамику.
При наличии ишемической болезни сердца препаратом выбора является соталол, на 1/3 являющийся, как известно, b–адреноблокатором. Но при его неэффективности в нашем распоряжении вновь только амиодарон. Что же касается больных с артериальной гипертензией, то из их числа, в свою очередь, выделяются пациенты с выраженной и невыраженной гипертрофией левого желудочка. Если гипертрофия невелика (в Руководстве 2001 г. – толщина стенки левого желудочка менее 14 мм), препарат выбора – пропафенон, но при его неэффективности – как всегда, амиодарон (наряду с соталолом). Наконец, при выраженной гипертрофии левого желудочка, как и при хронической сердечной недостаточности, амиодарон – единственный возможный препарат.
Источник: Остроумова О. Д. Удлинение интервала QT. РМЖ №18 2001 С 750-54
Статья добавлена 11 апреля 2015 г.
.gif)
.gif)
.gif)
.gif)
_575.gif)
_575.gif)
_575.gif)