Редуксин или орлистат что лучше
Редуксин или орлистат что лучше
• смесь кофеина и эфедрина, повышающая энергетические затраты;
• антагонисты опиоидных рецепторов налоксон и налтрексон;
• вещества, увеличивающие объем пищевой массы, такие как метилцеллюлоза. Терапевтическая оценка таких средств затруднена, и их широкое использование пока не рекомендуется.
Существуют два препарата, разрешенные для клинического применения в качестве средств против ожирения. Это сибутрамин и орлистат. При постоянном приеме этих средств вместе с диетической терапией и изменением пищевого поведения можно ожидать снижение массы тела до 10%:
• сибутрамин является ингибитором обратного захвата серотонина и норадреналина, уменьшает аппетит (потребление пищи) и увеличивает энергетические затраты;
• орлистат — это ингибитор панкреатической липазы, который снижает абсорбцию жира в тонкой кишке за счет ингибирования расщепления триглицеридов.
Сибутрамин
Сибутрамин блокирует обратный захват серотонина и норадреналина в ЦНС через малоизученные механизмы, которые могут участвовать в подавлении аппетита (стимулирование чувства насыщения) и повышении энергетических затрат (повышение скорости метаболизма). Начальная доза составляет 10 мг/сут, и, если снижение массы не происходит в течение 4 нед, дозу увеличивают до 15 мг/сут. Препарат способствует снижению массы на 7-10% с преимущественным уменьшением висцерального жира. Максимальное снижение массы достигается к 6 мес и удерживается в течение периода приема препарата. При пероральном приеме сибутрамин быстро всасывается, но при первом прохождении через печень подвергается полному метаболизму CYP3A4 до двух активных метаболитов — Ml (монодезметилсибутрамин) и М2 (дидезметилсибутрамин).
И сибутрамин, и его метаболиты на 94-97% связываются с белками плазмы. Элиминируется преимущественно почками. Возможно наличие фармакокинетического взаимодействия с веществами, ингибирующими CYP3A4 (эритромицином, циметидином, кетоконазолом).
Побочные эффекты включают тахикардию, сухость во рту, запор, бессонницу и повышение артериального давления. Препарат противопоказан при сердечно-сосудистых и цереброваскулярных заболеваниях с плохо контролируемой гипертензией.
Орлистат
Орлистат в дозе 120 мг 3 раза в день ингибирует панкреатическую липазу и тем самым снижает абсорбцию липидов в желудочно-кишечном тракте. Орлистат способствует снижению массы тела на 10% у лиц, принимающих препарат до 2 лет в комбинации с гипокалорийной диетой. Препарат плохо всасывается, поэтому его концентрация в плазме обычно низкая ( 95%) и в незначительных количествах экскретируется с мочой.
Побочные системные эффекты связаны с энтеральной абсорбцией. В основном отмечают жалобы на изменения со стороны желудочно-кишечного тракта, обусловленные ингибированием всасывания липидов, включая стеаторею и частый стул. Потенциальные долгосрочные эффекты снижения абсорбции липидов на функцию кишечника неизвестны. Противопоказаний для назначения орлистата нет, и нет данных о его взаимодействии с лекарствами. Однако имеет значение снижение всасывания жирорастворимых витаминов.
Ожирение. Медикаментозное похудение
«Волна похудения» захлестнула общество. Худеют и те кому это показано и те, у кого пролебмы избытка веса не было. Рынок средств для похудения в Росии достаточно широк, препараты покупаются, к сожалению, бесконтрольно, а ведь многие из них не так безопасны. Далее обзор некоторых групп препаратов.
Для эффективного похудения необходимо: знать степень избытка веса, цель похудения (в килограммах), тип распределения подкожной клетчатки, причину избытка веса (есть ли гормональные нарушения, даже в субклинической форме), предупредить врача о наличии отёков и/или лимфостаза, хронических патологий (особенно заболеваний почек!, артериальной гипертензии, желчно-каменной болезни и др.). При необходимости провести дополнительные обследования состояния здоровья.
Во первых, необходимо изменить характер питания, индивидуальную диету можно рассчитать у диетолога.
Во вторых, необходима физическая нагрузка (не менее 150 минут в неделю). При этом частота пульса является основным показателем эффективности нагрузок и рассчитывается по формуле:(220-возраст)*0.65.
Теперь непосредственно о препаратах.
Многие из похудательных препаратов являются БАДами, используются при ИМТ(индексе массы тела) более 30, или ИМТ более 27 при наличии сопутствующего сахарного диабета, нарушений холестеринового обмена и др.
В России официально разрешены к использованию 2 препарата для похудения:
Далее следуют только БАДы, к ним относятся:
🙂 балластные вещества (источники дополнительной клетчатки )- МКЦ 229, Анкир Б и др.,могут использоваться при похудении,
8) Диетресса (новинка продаж)- блокатор каннабиоидных рецепторов, нормализует центр пищевого поведения(?). Эффективность при использовании в стадии накопления опыта.
Менопаузальный метаболический синдром
Менопаузальный метаболический синдром (ММС) — это совокупность метаболических нарушений, возникающих с наступлением менопаузы и включающих быструю прибавку массы тела с формированием абдоминального ожирения, инсулинорезистентности и дислипидемии и/или ар
Менопаузальный метаболический синдром (ММС) — это совокупность метаболических нарушений, возникающих с наступлением менопаузы и включающих быструю прибавку массы тела с формированием абдоминального ожирения, инсулинорезистентности и дислипидемии и/или артериальной гипертензии. Возможны и другие метаболические проявления ММС: микроальбуминурия и нарушения в системе гемостаза.
ММС впервые был описан в 1995 г. Частота ММС зависит от возраста. Согласно данным исследования, проведенного в США и охватившего 9 000 мужчин и женщин, ММС был выявлен у 43,6% в возрасте 60–69 лет и у 42% лиц от 70 лет и старше.
Этиология ММС неизвестна. Существует несколько теорий, указывающих на роль следующих факторов в развитии ММС: дефицит эстрогенов и прогестерона; повышение тонуса симпатической нервной системы; гиперандрогения; инсулинорезистентность; дефицит инсулинподобного фактора роста; роль провоспалительных цитокинов (фактор некроза опухоли α(ФНО α), С-реактивный белок, интерлейкин (ИЛ) 6 и 10).
ММС представляет собой предстадию сахарного диабета (СД) 2 типа и отличается от последнего отсутствием стабильной гипергликемии, поскольку инсулинорезистентность в этой стадии еще может преодолеваться за счет гиперинсулинемии. Снижение массы тела за счет расширения двигательной активности и адекватной диеты уменьшает риск развития СД 2 типа на 30–50% даже в этой стадии.
Термин «метаболический синдром» имеет несколько синонимов: синдром Х, синдром инсулинорезистентности, «смертельный квартет» (верхний тип ожирения, нарушение толерантности к глюкозе, гиперлипидемия, артериальная гипертензия).
Все компоненты метаболического синдрома: инсулинорезистентность, дислипопротеинемия, гиперактивность симпатической нервной системы — так или иначе взаимообусловлены, но каждый из них неизбежно связан с избыточным количеством абдоминального и висцерального жира. Именно на этом основании абдоминальное ожирение считается ключевым признаком метаболического синдрома (рис. 1).
Следовательно, все элементы ММС взаимосвязаны между собой и становятся триггерами друг друга, создавая «порочный круг». ММС является определяющим в патогенезе ишемической болезни сердца у женщин в постменопаузе.
Половые гормоны определяют характер распределения жировой ткани: эстрогены и прогестерон влияют на локализацию жира в ягодично-бедренной области (гиноидный тип), андрогены отвечают за андроидный (абдоминальный) тип ожирения с абдоминальной локализацией жира. Кроме того, жировая ткань является местом экстрагонадного синтеза и метаболизма эстрогенов при участии ароматазы цитохрома Р450. Повышение активности ароматазы с возрастом способствует медленной биологической трансформации в ответ на выключение гормонов яичников.
Абдоминальное ожирение — основной клинический симптом ММС. Абдоминальное, и особенно висцеральное, ожирение является фактором риска сердечно-сосудистых заболеваний (рис. 2).
При ММС дефицит половых гормонов ведет к снижению уровня глобулина, связывающего половые стероиды, что способствует увеличению содержания свободных андрогенов в кровотоке, которые сами по себе могут снижать холестерин ЛПВП и вызывать инсулинорезистентность, гиперинсулинемию и андроидное распределение жира.
При ожирении и инсулинорезистентности часто выявляется активация факторов провоспалительной реакции (ФНО α, ИЛ-6, ИАП-1 и др.), что ведет к эндотелиальной дисфункции, оксидативному стрессу, воспалительному каскаду цитокинов, способствуя возникновению атеросклеротических изменений и развитию инсулинорезистентности.
Критерии диагноза ММС. Данные анамнеза: значительная прибавка массы тела (5–10 кг) за короткий период времени (6–12 месяцев) с наступлением менопаузы.
Терапевтические подходы
Существует два основных метода терапии ожирения: немедикаментозный и медикаментозный.
Немедикаментозный подход к лечению ожирения. Для эффективного лечения ММС необходимы: формирование и поддержание внутренней мотивации пациентки к снижению массы тела; постоянный контакт с пациенткой с постановкой и согласованием промежуточных целей лечения и контролем за их достижением.
Пациентка должна усвоить следующее: избыточный вес и ожирение требуют пожизненного и многопланового внимания; масса тела регулируется сложными биологическими механизмами и влияниями внешней среды. Ее избыток не является следствием отсутствия воли; даже умеренное снижение массы тела приводит к улучшению общего состояния; ненаучный подход в борьбе с избыточной массой тела мешает лечебному процессу; важно постепенное и стойкое снижение массы тела и осуществление мероприятий, способствующих поддержанию достигнутого результата.
Итак, немедикаментозное лечение включает: обучение больных, рациональное гипо- и эукалорийное питание, повышение физической активности, изменение образа жизни.
Существует также оперативное лечение.
Медикаментозная терапия. Лечение включает разные группы препаратов.
ЗГТ является патогенетической терапией ММС, поскольку синдром развивается со снижением и возрастным «выключением» функции яичников.
В постменопаузе при сохраненной матке назначается низкодозированная комбинированная (эстроген-гестагенная) ЗГТ: анжелик (Шеринг), фемостон 1/5 (Солвей Фарма). Лечение проводится в непрерывном режиме в течение 3–5 и более лет (табл).
Если имеются противопоказания для пероральной терапии (заболевания желудочно-кишечного тракта, тромбофлебиты в анамнезе, мигрень, АД > 170/100 мм рт. ст. и др.), то назначаются эстрогены парентерально в виде пластыря или геля (климара, дивигель, эстрожель) в непрерывном режиме с добавлением прогестагенов (дюфастон 5 мг/сут или утрожестан 100 мг/сут) в непрерывном режиме. Поскольку ММС может развиться в перименопаузе на фоне длительных задержек менструаций, предпочтение отдается двухфазной ЗГТ (табл).
Женщинам без матки назначается монотерапия эстрогенами без прогестагенов.
Наши данные показали, что на фоне ЗГТ в течение 12 мес у подавляющего большинства женщин (96,1%) наблюдалось прогрессивное снижение массы тела в среднем на 4,5 кг и снижение индекса ОТ/ОБ. Кроме того, отмечено достоверное снижение атерогенных фракций липидов, инсулина, нормализация АД. Более быстрый эффект наблюдался у женщин в перименопаузе.
ЗГТ должна назначаться врачом гинекологом после соответствующего обследования: маммография, ультразвуковое исследование гениталий, цитологическое исследование мазков из шейки матки и др.
С учетом данных о механизмах влияния половых гормонов на жировую ткань можно полагать, что перераспределение жировой ткани в большей степени обусловлено влиянием дефицита половых гормонов, чем возрастных процессов.
Механизм действия селективного ингибитора обратного захвата серотонина и норадреналина сибутрамина (меридиа) заключается в избирательном ингибировании обратного захвата нейромедиаторов серотонина и норадреналина в синапсах нейронов центральной нервной системы, результатом чего является более быстрое возникновение и пролонгирование чувства насыщения и, как следствие, уменьшение объема потребляемой пищи. Помимо усиления чувства насыщения, меридиа повышает расход энергии, стимулируя термогенез.
Препарат меридиа (Эбботт) назначался в начальной дозе 10 мг в сутки в течение 4 нед, после чего больным с потерей массы тела менее 2 кг дозу препарата увеличивали до 15 мг в сутки.
Критерием эффективности лечения ожирения являются снижение массы тела, индекса ОТ/ОБ, улучшение липидного спектра крови. Полученные нами данные указывают на преимущественное влияние меридиа на жировую ткань абдоминальной локализации. Продолжительность терапии сибутрамином может составлять 6–12 и более месяцев.
Препарат ксеникал (орлистат) (Ф. Хоф- фманн-Ля Рош Лтд.) является ингибитором желудочно-кишечных липаз. Снижение массы тела обусловлено уменьшением поступления в организм жиров и созданием отрицательного энергетического баланса (дефицита калорий). Ксеникал помогает добиться снижения массы тела, даже если первоначальное изменение образа жизни оказалось неэффективным, поскольку он способствует выработке мотивации к изменению диеты. Снижая количество свободных жирных кислот и моноглицеридов в тонком кишечнике, ксеникал понижает растворимость, а следовательно, и всасывание холестерина.
Доза 120 мг 3 раза в день является наиболее действенной в отношении снижения массы тела (в среднем на 9,8% от исходного). Наряду со снижением веса на фоне ксеникала отмечаются нормализация или достоверное снижение АД, общего холестерина, холестерина ЛПНП, триглицеридов, что свидетельствует об уменьшении риска развития сердечно-сосудистых заболеваний. Лечение проводится в течение нескольких лет.
Больным с ожирением, у которых сниженная насыщаемость, эмоциогенное пищевое поведение сопровождаются тревожно-депрессивными расстройствами, паническими атаками, а также пациентам с невротической булимией показаны антидепрессанты — селективные ингибиторы обратного захвата серотонина.
Флуоксетин назначается в суточной дозе от 20 до 60 мг в течение 3 мес. Флувоксамин назначается в суточной дозе от 50 до 100 мг в день также в течение 3 мес. Указанные средства предпочтительно назначать при наличии у пациентов с ожирением тревожно-депрессивных расстройств, панических атак и невротической булимии под контролем невропатолога.
Таким образом, дефицит половых гормонов в постменопаузе может способствовать развитию ММС, который клинически проявляется прибавкой массы тела с формированием абдоминального ожирения за короткий промежуток времени (6–10 мес). Выбор метода лечения ММС зависит от сопутствующих заболеваний и степени ожирения. Патогенетически обоснованными и эффективными средствами при ММС являются: назначение ЗГТ, а также препаратов для лечения ожирения, таких как сибутрамин (меридиа) — препарат с центральным механизмом действия, усиливающий чувство насыщения и термогенез, и орлистат (ксеникал) —препарат периферического действия, подавляющий активность липаз желудочно-кишечного тракта, клинический опыт применения которого накапливается. Безусловно, назначая фармакологические средства, врач также дает пациенту рекомендации соблюдать низкокалорийную диету и поддерживать физическую активность, что значительно повышает эффективность лечения.
В. П. Сметник, доктор медицинских наук, профессор
НЦАГиП, Москва
Применение орлистата и пиоглитазона при синдроме поликистозных яичников и ожирении
Проведена сравнительная оценка влияния 6-месячного курса терапии орлистатом (n = 20) и пиоглитазоном (n = 11) на метаболические параметры и эндокринную функцию репродуктивной системы больных с синдромом поликистозных яичников (СПКЯ) и ожирением.
Проведена сравнительная оценка влияния 6-месячного курса терапии орлистатом (n = 20) и пиоглитазоном (n = 11) на метаболические параметры и эндокринную функцию репродуктивной системы больных с синдромом поликистозных яичников (СПКЯ) и ожирением. После приема орлистата масса тела снизилась на 11,3 ± 1,3 кг, после пиоглитазона — повысилась на 2,9 ± 0,7 кг. Коррекция гиперинсулинемии и инсулинорезистентности на фоне двух видов терапии носит схожий характер, однако орлистат характеризуется более выраженным положительным воздействием на показатели липидного спектра крови и толерантность к глюкозе. Препараты оказывают сопоставимый эффект на гормональные показатели, что проявляется тенденцией к снижению гонадотропинов, нормализацией уровня соматотропного гормона (СТГ) и достоверным снижением уровня тестостерона. Применение орлистата приводит к повышению половых стероидсвязывающих глобулинов (ПССГ) и соответственно к более выраженному снижению индекса свободных андрогенов. Лечение орлистатом, как и пиоглитазоном, сопровождается регуляцией ритма менструаций примерно у каждой второй пациентки с СПКЯ и ожирением.
СПКЯ является одной из наиболее распространенных причин нарушений менструального цикла, гирсутизма и бесплодия, по поводу которых молодые женщины обращаются к гинекологу. С современных позиций СПКЯ трактуется как своеобразная форма метаболического синдрома, для которой характерны инсулинорезистентность, гиперинсулинемия, дислипопротеидемия и повышенный риск возникновения сахарного диабета (СД) 2 типа и кардиоваскулярных заболеваний [9, 10, 17, 20, 34 ]. Известно, что гиперинсулинемия за счет прямого и опосредованного влияния на стероидогенез в яичниках может индуцировать секрецию андрогенов, а также повышать их биологическую активность, в связи с чем ее можно считать одним из ведущих факторов нарушения функции яичников, приводящих к бесплодию при СПКЯ [7, 11, 27]. В связи с этим в качестве консервативной терапии больных с СПКЯ с успехом используются инсулиносенситайзеры: с середины 1990-х г. — бигуаниды (метформин) и тиазолидиндионы I поколения (троглитазон), а с начала нового столетия — накапливается опыт по применению тиазолидиндионов II поколения (розиглитазон и пиоглитазон). Терапия этими препаратами способствует не только улучшению чувствительности к инсулину и снижению гиперинсулинемии, но и коррекции гормональных нарушений, что, в свою очередь, восстанавливает ритм менструаций и фертильность у женщин с СПКЯ.
СПКЯ часто сочетается с ожирением, являющимся самостоятельным фактором риска инсулинорезистентности, гиперинсулинемии и развития метаболических нарушений, которые ассоциируются с репродуктивной дисфункцией [15, 36, 38]. Адекватное снижение массы тела способствует коррекции гормональных, метаболических нарушений и регуляции ритма менструаций у больных с ожирением и нарушениями функции яичников [4, 5, 12, 23, 24, 28, 32]. Проводившиеся нами ранее исследования показали, что монотерапия орлистатом позволяет восстановить овуляцию у каждой третьей женщины с ожирением и эндокринным бесплодием [5]. Публикации, посвященные использованию фармакопрепаратов, снижающих массу тела, при СПКЯ, крайне малочисленны [26]. Вместе с тем логично предположить, что такая терапия у больных с СПКЯ и ожирением будет не менее эффективной, чем применение инсулиносенситайзеров, которые не оказывают существенного влияния на массу тела.
Целью исследования стала сравнительная оценка влияния орлистата и пиоглитазона на метаболические параметры и эндокринную функцию репродуктивной системы женщин с СПКЯ и ожирением.
В исследование были включены 31 женщина в возрасте от 18 до 40 лет с СПКЯ и ожирением. В зависимости от вида проводимой терапии пациентки были разделены на две группы: 1-ю составили 20 женщин, которым был назначен орлистат (ксеникал — Хоффман Ла Рош, Швейцария) в суточной дозе 360 мг, 2-ю — 11 женщин, которым был рекомендован пиоглитазон (актос — Eli Lilly, США) в суточной дозе 30 мг. Длительность терапии составила 6 мес. Диагностика СПКЯ проводилась на основании характерных клинических, эхографических и гормональных признаков. Женщины с дефицитом 21-гидроксилазы, гиперпролактинемией, болезнью Кушинга и андрогенпродуцирующими опухолями в исследование не включались. В течение 3 мес, предшествующих началу лечения, пациентки не принимали гормональных препаратов. Критериями исключения явились противопоказания к назначению орлистата и пиоглитазона, беременность, лактация, тяжелая сопутствующая соматическая и психическая патологии, СД с медикаментозной терапией, прием гиполипидемических, ферментативных препаратов, содержащих липазу, а также трициклических антидепрессантов.
Средний возраст женщин, которым была назначена терапия орлистатом, составлял 27,7 ± 0,9 лет, пиоглитазоном — 25,6 ± 1,4 года. Средняя масса тела соответственно — 92,3 ± 3,3 кг и 82,6 ± 3,4 кг; индекс массы тела (ИМТ) — 33,8 ± 0,9 и 30,1 ± 0,7; объем талии (ОТ) — 97,7 ± 2,1 см и 92,4 ± 2,1 см; объем бедер (ОБ) — 114,9 ± 2,3 см и 109,1 ± 2,8 см; ОТ/ОБ — 0,85 ± 0,01 и 0,85 ± 0,02.
У всех больных, включенных в исследование, до и после лечения проводился мониторинг антропометрических, метаболических и гормональных показателей, а также оценивался характер менструального цикла. Все пациентки 2-й группы прошли 6-месячный курс терапии, из 1-й группы 3 человека были исключены из исследования: одна в связи с беременностью после 3-месячного лечения орлистатом, другая в связи с холецистэктомией, еще одна женщина отказалась от приема препарата по причинам, не связанным с побочными явлениями в результате проводимой терапии.
Радиоимунными методами с использованием тест-систем Immunotech (Чехия) или ИБОХ (Беларусь), согласно приложенным к ним инструкциям, проводилось исследование содержания в сыворотке крови больных лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов, эстрадиола (Е2), СТГ, тестостерона и ПССГ. По расчетным формулам вычислялись свободный андрогенный индекс (САИ) = 100 х тестостерон (нмоль/л)/ ПССГ(нмоль/л) и свободный эстрогенный индекс (СЭИ) = 0,1 х Е2 (пмоль/л)/ ПССГ(нмоль/л). Гиперинсулинемия диагностировалась на основе определения уровня имунореактивного инсулина (ИРИ) натощак и результатов перорального 2-часового глюкозотолерантного теста (ГТТ) с 75 г глюкозной нагрузки, который проводился исходно и через 6 мес от начала терапии. Содержание ИРИ оценивалось методом IRMA, с использованием тест-систем ИБОХ (Беларусь). Количественная оценка инсулиновых ответов на глюкозную нагрузку проводилась расчетным путем по величинам молярных площадей (S) под соответствующими секреторными кривыми, рассчитанными по трапецевидному правилу. Инсулинорезистентность оценивалась по расчетному индексу: HOMA (Homeostasis model assessment) = ИРИ (мкЕД/мл) х глюкоза (ммол/л)/22,5.
Статистический анализ проводился с использованием программ «Statistica-6»; для определения значимости (достоверности) различий сопоставляемых величин использовали непараметрические критерии Вилкоксона для связанных совокупностей, различия считали достоверными при p ё 0,05.
После 6-месячного курса терапии орлистатом масса тела снизилась на 11,3 ± 1,3 кг (с 92,4 ± 3,3 до 79,2 ± 3,5 кг), что составило 13,0 ± 1,3 % от исходного значения. Если до лечения ожирение III степени встречалось у 10 % больных, то после лечения ни у одной больной столь выраженного ожирения уже не отмечалось, частота ожирения II степени снизилась в 2,5 раза (от 30 до 11,8%), I степени — в 1,7 раза (с 50 до 29,4%), соответственно увеличилась частота избыточной массы тела с 10 до 58,8%. На фоне терапии пиоглитазоном снижения массы тела ни у одной пациентки не отмечалось, у 3 (27,3%) больных вес оставался стабильным, у 8 (72,3%) выявлялось его увеличение. Масса тела выросла от 82,4 + 3,7 до 84,8 + 3,7 кг, что в среднем составило 2,9 ± 0,7 кг. При этом случаев развития ожирения у пациенток с избыточной массой тела, а также увеличения числа больных с выраженными степенями ожирения выявлено не было.
Применение орлистата сопровождалось закономерной коррекцией антропометрических параметров: достоверно снизилось среднее значение ОТ (до лечения — 97,7 ± 2,1; после — 84,7 ± 2,4), ОБ (до лечения — 114,9 ± 2,3; после — 102,4 ± 2,5); ОТ/ОБ (до лечения 0,85 ± 0,01; после — 0,83 ±0,01) (p 0,05).
Применение обоих видов терапии оказывало влияние на метаболические параметры. На фоне приема орлистата и пиоглитазона произошло достоверное снижение содержания триглицеридов в сыворотке крови больных (табл. 1). После приема орлистата частота гипертриглицеридемии снизилась примерно в 2,5 раза (с 30 до 11,8%), в группе пиоглитазона как до, так и после лечения не выявлено ни одного случая гипертриглицеридемии, хотя общий уровень триглицеридов тоже снизился. Существенных изменений средних уровней холестерина в обеих группах отмечено не было. Вместе с тем более детальный анализ показал, что если до лечения орлистатом гиперхолестеринемия выявлялась у 15 (75%) больных, то после лечения она была диагностирована у 9 человек (52,9%), в группе больных, получавших пиоглитазон, эти показатели составили 6 (54,5%) и 5 (45,5%). Как видно из данных, представленных в таблице 1, положительная динамика липидных показателей сыворотки крови после приема орлистата проявлялась в достоверном повышении холестерина липопротеидов высокой плотности (ЛПВП), тогда как после приема пиоглитазона содержание этой фракции липопротеидов существенно не изменилось. Гипо-a-липопротеидемия до приема орлистата встречалась у 14 (70%) больных, после — у 7 (41,2 %), в группе пиоглитазона у 6 (54,5%), как до, так и после терапии.
Результаты исследования указывают на положительный эффект двух видов терапии на чувствительность к ИРИ, о чем свидетельствует снижение средних показателей индекса HОМА (табл. 1).
Проведенная терапия оказала влияние на содержание гормонов в сыворотке в крови. Из данных, представленных в таблице 2, видно, что среднее содержание гонадотропинов на фоне двух видов терапии существенно не изменилось. Однако если до начала терапии повышенный уровень ЛГ диагностировался у 11 (55%) больных 1-й группы и у 6 (54,5%) больных 2-й группы, то после проведенного лечения эти показатели составили 35,3 и 63,6%. Повышение индекса ЛГ/ФСГ ( 2,5 до лечения орлистатом отмечалось у 9 (45%) больных, после лечения — у 4 (23,5%), т. е. снизилось в 1,9 раз, на фоне пиоглитазона частота повышенного индекса ЛГ/ФСГ значительно не изменилась — 5 (45,5%) и 6 (54,5%). На фоне обоих видов терапии отмечена четкая тенденция к нормализации исходно низких значений СТГ (табл. 2).
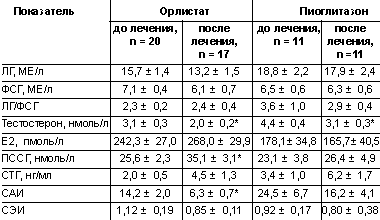 |
| Таблица 2. Средние показатели гормонов крови больных с СПКЯ и ожирением на фоне двух видов терапии (M ± m) |
На фоне приема как пиоглитазона, так и орлистата достоверно снизился средний уровень тестостерона в крови — по сравнению с исходным показателем. Следует отметить, что исходно повышенные уровни тестостерона были выявлены у 13 (65%) пациенток, после лечения орлистатом лишь у 2 (11,8%). Во 2-й группе исходные уровни тестостерона были повышены у 10 (90,9%) больных, после приема пиоглитазона — у 6 (54,5%) пациенток.
Терапия орлистатом сопровождалась достоверным ростом исходно низкого уровня ПССГ, тогда как прием пиоглитазона не оказывал существенного влияния на уровень этого транспортного белка (табл. 2). Эти изменения сказались на средних показателях САИ, которые после 6-месячного приема орлистата снизились примерно в 2,2 раза, после пиоглитазона — в 1,5 раза.
Коррекция гормональных параметров клинически проявлялась положительными изменениями в характере менструального цикла. После приема орлистата частота ановуляции снизилась со 100 до 41,2%, частота олигоменореи — с 85 до 41,2%. У 58,8% больных удалось добиться регуляции ритма менструаций, при этом двухфазный цикл восстановился у 5 (29,4%) пациенток, еще у 5 (29,4%) диагностирована недостаточность лютеиновой фазы менструального цикла. Положительная динамика в характере менструального цикла отмечалась и на фоне пиоглитазона, после 6-месячного приема препарата частота регулярного цикла выросла от 9,1 до 45,5 %. На рисунке отражена частота нарушения менструального цикла на фоне двух видов терапии.
К концу 3-го месяца приема орлистата у одной пациентки наступила беременность. Переносимость препаратов у всех больных была хорошей. Побочные эффекты, возникшие на фоне орлистата, проявлявшиеся в виде диареи, маслянистых выделений из прямой кишки, метеоризма, были слабо выражены, отмечались в начале лечения и имели проходящий характер. Эти побочные явления являлись следствием неумеренного потребления жиров и свидетельствовали о достаточной эффективности препарата. Побочные эффекты, возникавшие на фоне приема пиоглитазона, выражались только в незначительном повышении массы тела.
В настоящее время в качестве одного из ведущих патогенетических механизмов возникновения СПКЯ рассматривается гиперинсулинемия, в результате сниженной чувствительности периферических тканей к действию инсулина [16, 29]. Частота ее возникновения и выраженность коррелируют с наличием и степенью ожирения, которое характерно примерно для 50% женщин с СПКЯ [36, 38]. Имеется достаточное количество доказательств того, что ожирение усугубляет выраженность гормональных и метаболических нарушений при СПКЯ и отягощает клиническое течение синдрома [1, 15, 31, 32]. Известно также, что традиционное использование комбинированных оральных контрацептивов с целью регуляции цикла и/или лечения гирсутизма нередко способствует прибавке массы тела и ухудшению метаболических параметров, что, в свою очередь, создает предпосылки к сохранению нарушений функций яичников. Эволюция взглядов на патогенез СПКЯ явилась основанием для пересмотра подходов к консервативной терапии и внедрения в клиническую практику лекарственных средств, повышающих чувствительность к инсулину, коррегирующих гиперинсулинемию и гиперандрогению [6, 16, 27]. Однако эти препараты не оказывают существенного влияния на снижение массы тела; остается открытым вопрос о возможности их длительного применения для коррекции метаболических и гормональных нарушений у больных с СПКЯ. В связи с этим нами была предпринята попытка провести сравнительную оценку эффективности инсулиносенситайзера — пиоглитазона, зарекомендовавшего себя в качестве одного из препаратов выбора при СПКЯ, и орлистата, являющегося эффективным медикаментозным средством для лечения ожирения.
Несмотря на столь выраженную разницу во влиянии на массу тела оба вида терапии оказывали положительный эффект на метаболические параметры. Под влиянием обоих препаратов частота гиперинсулинемии снизилась примерно в 3 раза, после приема пиоглитазона в 1,5 раза реже выявлялось НТГ, после приема орлистата случаев НТГ диагностировано не было. Указанные изменения во многом обусловлены нормализацией чувствительности периферических тканей к ИРИ в результате прямого влияния пиоглитазона на механизмы передачи инсулинового сигнала за счет стимуляции пероксисомального пролиферата PPARg и опосредованного влияния орлистата путем ингибирования циркулирующих свободных жирных кислот и снижения глюконеогенеза в печени [21, 33]. О повышении чувствительности к ИРИ косвенно свидетельствует снижение индекса HОМА, который рассматривается в качестве возможного и доступного критерия инсулинорезистентности. Отсутствие выраженных изменений данного показателя можно объяснить его значительной вариабельностью и небольшой выборкой больных [26].
Наряду с уменьшением степени выраженности гиперинсулинемии и инсулинорезистентности на фоне пиоглитазона и особенно орлистата наблюдались положительные сдвиги в липидном спектре крови. Так, хотя потери массы тела зафиксировано не было, прием пиоглитазона сопровождался достоверным уменьшением содержания триглицеридов в сыворотке крови. В ряде работ других исследователей также было отмечено триглицеридснижающее действие тиазолидиндионов [14], причем наиболее выраженным эффектом обладал пиоглитазон, который в меньшей степени увеличивал уровень холестерина ЛПНП [18, 25]. Несмотря на более выраженные исходные метаболические нарушения, в частности большую массу тела, у пациенток, принимавших орлистат, отмечалась более выраженная динамика как атерогенных, так и антиатерогенных фракций липопротеидов — определялось снижение суммарного атерогенного потенциала крови. Нормализация липидного спектра крови в значительной степени связана со снижением гиперинсулинемии, которая индуцирует возникновение липидных нарушений. Более выраженные сдвиги, выявленные после приема орлистата, могут быть обусловлены дополнительным ингибирующим эффектом препарата на абсорбцию липидов в желудочно-кишечном тракте.
Коррекция метаболических нарушений сочеталась с нормализацией гормональных показателей. Наибольшие изменения касались содержания тестостерона (снижение на фоне пиоглитазона составило примерно 30%, на фоне орлистата — 35%). Традиционно считается, что снижение уровня тестостерона в значительной степени связано с уменьшением гиперинсулинемии, приводящей к снижению стимулирующего влияния ИРИ на ферментативную активность клеток яичника, в частности на цитохром Р-450 и, соответственно, на секрецию андрогенов [ 27]. Однако имеются данные и о прямом ингибирующем влиянии тиазолидиндионов на ферментативную активность и биосинтез яичниковых андрогенов [8]. Секреция тестостерона в яичниках регулируется ЛГ. Однако лечение обоими препаратами не повлекло за собой значительного снижения уровня этого гормона, которое могло бы объяснить уменьшение тестостерона.
Известно, что ИРИ способствует увеличению свободных фракций андрогенов за счет ингибирования синтеза ПССГ печенью [19, 35]. По результатам данного исследования значительного изменения этого показателя, особенно после приема пиоглитазона, обнаружено не было. Это можно объяснить небольшим числом прошедших курс лечения больных, поскольку в ранее проведенных нами исследованиях, выполненных на большем количестве клинических наблюдений, даже через 3 мес терапии отмечалось достоверное повышение уровня ПССГ [5, 6].
Результаты исследования четко продемонстрировали повышение исходно низких уровней СТГ как после лечения пиоглитазоном, так и орлистатом. В литературе также имеются данные о нормализации содержания СТГ в сыворотке крови больных с ожирением на фоне снижения массы тела [30]. Однако, учитывая отсутствие снижения массы тела у больных, лечившихся пиоглитазоном, можно полагать, что в этом случае данный механизм не вовлечен в коррекцию уровня СТГ.
Коррекция гормональных нарушений сопровождалась нормализацией ритма менструаций, частота ановуляции в обеих группах снизилась примерно в 2 раза. После курса терапии пиоглитазоном регулярный менструальный цикл восстановился у 45% больных с СПКЯ и ожирением, после терапии орлитатом — у 58,8%. Это привело к наступлению беременности у 3 больных в 1-й группе (у одной на фоне и у 2 после отмены лечения), во 2-й группе после лечения беременность наступила также у 2 больных. Полученные данные согласуются с результатами большинства исследований, демонстрирующих, что коррекция гиперинсулинемии и яичниковой гиперандрогении может способствовать нормализации ритма менструаций и восстановлению фертильности [19, 26, 35].
Таким образом, на основании всего вышесказанного можно сделать заключение, что оба препарата одинаково эффективны в коррекции гиперинсулинемии, яичниковой гиперандрогении и лечении хронической ановуляции у больных с СПКЯ и ожирением. Орлистат, эффективно снижая массу тела, оказывает более выраженное положительное влияние на метаболические параметры. Анализ результатов работы дает основание рекомендовать применение орлистата, наряду с пиоглитазоном, для коррекции эндокринной функции репродуктивной системы у женщин с СПКЯ и ожирением.
По вопросам литературы обращайтесь в редакцию.
Г. Е. Чернуха, доктор медицинских наук
М. И. Купрашвили,
В. Л. Шевцова
НЦАГиП РАМН, Москва