кокарбоксилаза при беременности 3 триместр для чего назначают
Кокарбоксилаза, витамин В2 и липоевая кислота в акушерско-гинекологической практике
В последние годы на фоне резкого снижения рождаемости в Москве отмечается существенное нарастание частоты перинатальной патологии (в 1,5–2 раза), стабилизация частоты и рождения недоношенных детей (7–9%).
В последние годы на фоне резкого снижения рождаемости в Москве отмечается существенное нарастание частоты перинатальной патологии (в 1,5–2 раза), стабилизация частоты и рождения недоношенных детей (7–9%). Наблюдается определенный патоморфоз заболеваний периода новорожденности, патогенетически связанный с ухудшением состояния здоровья матерей. Большинство заболеваний у детей характеризуется полисистемными нарушениями, нейросоматическими расстройствами, протекающими на фоне значительно сниженной резистентности в репаративном периоде таких заболеваний, как перинатальная энцефалопатия, сепсис, пневмония, респираторный дистресс-синдром. У большинства детей отмечаются стойкие нарушения функций различных органов и систем, развивается синдром дизадаптации (синдром повышенной возбудимости, дисбактериоз, дискинезия желудочно-кишечного тракта, аллергические реакции, затяжное и рецидивирующее течение ОРВИ).
Существует прямая связь между цитохимическими показателями беременной женщины и гистохимическими показателями развивающегося плода. Показатели ферментного статуса лимфоцитов женщины на 7–10 неделе являются прогностически значимыми для оценки состояния энергетического обмена у развивающегося ребенка в течение всей беременности. Не менее важно и динамическое наблюдение за состоянием энергетического обмена у детей различного возраста, особенно у новорожденных и детей первого года жизни. Изменения энергетического метаболизма клеток головного мозга, кардиомиоцитов, эпителиальных клеток слизистой оболочки кишечника у новорожденного ребенка, перенесшего хроническую антенатальную или острую интранатальную гипоксию, приводят к формированию дисфункций вышеперечисленных органов, что нарушает процессы адаптации новорожденного ребенка. Своевременно назначенная эффективная метаболитная терапия позволяет корригировать нарушения энергетического обмена клеток и предотвратить развитие подобных дисфункций.
Контроль за состоянием энергетического обмена у беременной женщины позволяет своевременно выявлять тканевую гипоксию плода и вовремя принимать меры по ее коррекции.
В настоящий момент накоплен большой клинический материал по применению различных схем метаболической терапии, назначаемых в зависимости от показателей цитохимического исследования крови и лежащих в основе профилактики развития патологии беременности. Применение этих схем при подготовке к беременности и во время нее позволяет оптимизировать процессы энергообмена и снижает риск перинатальной патологии у будущего ребенка.
Совокупность выявленных цитохимических изменений определяет направленность метаболитной терапии. В настоящий момент на основании цитохимических исследований энергетического обмена разработан целый ряд комбинированных препаратов метаболического действия. В частности, при низких показателях активности митохондриальных флавопротеидов обосновано применение кофакторов цикла трикарбоновых кислот. Однако известно, что парентеральное введение препаратов-метаболитов более эффективно, по сравнению с энтеральным, а это резко ограничивает назначение данных препаратов в амбулаторной практике. Как альтернатива парентеральному пути введения предлагаются метаболические комплексы в виде суппозиториев. Биодоступность препаратов при подобном пути введения значительно повышается и по степени эффективности не уступает той, которая наблюдается при парентеральном пути введения. При разработке подобных комплексов основное внимание уделяется синергизму действия препаратов при коррекции биохимических процессов в клетке.
Как известно, все продукты питания в организме расщепляются до ацетил-КоА, который вступает в конечный путь окисления — в цикл трикарбоновых кислот. Активация цикла ди- и трикарбоновых кислот возможна путем регуляции двух важных этапов: 1) окисления пировиноградной кислоты до ацетил-КоА и затем взаимодействия с оксалоацетатом до образования лимонной кислоты; 2) окисления кетоглутаровой кислоты до сукцината (янтарной кислоты). Оба эти этапа могут катализироваться полиферментным комплексом Корилип, в состав которого входит липоевая кислота, кокарбоксилаза и рибофлавин.
Материалы и методы
Исследования НИИ педиатрии совместно с Центром акушерства, гинекологии и перинатологии РАМН, с Московским противогерпетическим центром и с 25-м роддомом г. Москвы с участием 64 женщин группы риска и их детей, наблюдавшихся на протяжении года после рождения, доказали, насколько важно применение препаратов энергонормализующего действия у женщин, готовящихся к беременности, и у беременных.
Суппозитории Корилип применялись на фоне базисной терапии у 31 женщины во время беременности под обязательным контролем количественного цитохимического анализа. Только базисную терапию также получали 33 женщины группы сравнения. Ферментный статус лимфоцитов периферической крови исследовали в классическом варианте постановки реакции (Р. П. Нарциссов, 1969–1984 гг.), включающем определение активности сукцинатдегидрогеназы (СДГ) и глицерофосфатдегидрогеназы (ГФДГ), а также в различных модификациях классического варианта, позволяющих оценить проницаемость мембран и устойчивость локуса митохондрий, содержащего сукцинатдегидрогеназу. Проницаемость мембраны митохондрий опосредованно оценивали по активности СДГ после 10 мин инкубации. Исходили из того, что скорость образования продукта реакции при выявлении активности СДГ максимальна в первые минуты экспозиции и минимальна при времени экспозиции 60 минут.
Этот метод позволил определить не только среднюю активность фермента, как это делается в биохимических исследованиях, но и позволил рассматривать в качестве характеристик параметры распределения клеток по активности фермента — коэффициенты второго, третьего и четвертого порядка (коэффициенты вариации, асимметрии, эксцесса), а также меру клеточного разнообразия (относительную энтропию информации). Совокупность этих параметров распределения по активности фермента и составляет понятие ферментного статуса клеток крови. Таким образом, анализ клеточной популяции позволил выявить изменения различных клеточных субпопуляций на фоне еще неизмененной средней активности, т. к. эти изменения клеточной структуры появляются раньше клинических признаков заболевания.
Для оценки функциональной активности митохондрий использовали цитоморфоденситометрический метод определения активности СДГ. Анализ функциональной активности митохондрий на основе цитоморфоденситометрических параметров позволил выявить особенности течения патологического процесса на субклеточном уровне и оценить эффективность проводимого лечения.
Результаты
Установлено, что у беременных женщин группы риска, получавших курсовое лечение комплексом Корилип на фоне базисной терапии, частота осложнений беременности повторными ОРВИ в 2,5 раза ниже по сравнению с группой сравнения. У них реже отмечались обострения хронических очагов инфекции. Гипохромная анемия у беременных диагностировалась в 2,9 раз реже у получавших Корилип. Наиболее эффективное по отношению к ребенку применение Корилипа наблюдалось у женщин, получавших терапию за 6–9 месяцев до и во время беременности. Раннее применение препарата обеспечивало сведение к минимуму развитие перинатальных осложнений, способствовало лучшему развитию детей на первом году жизни за счет обеспечения более высокого уровня энергетики тканей и клеток беременной женщины, новорожденных и грудных детей.
Выявлено, что в течение беременности более обосновано назначение метаболического пособия в критические периоды (по цитохимическим показателям): 5–8 недель, 10–12 недель, 20-я неделя, 27–28 недель, 30–32 неделя, 35–37 недель, а особенно женщинам из группы высокого риска развития перинатальной патологии у детей. У женщин из группы высокого риска развития перинатальной патологии у детей, как правило, наблюдается снижение активности СДГ и альфа-ГФДГ на фоне деформации структуры популяции в виде сниженного количества лимфоцитов с типичной активностью (эксцесс меньше –0,8). Для них обосновано назначение комплекса Корилип как в качестве самостоятельного лечения, так и в комплексе со специализированной терапией. Как правило, необходимо не менее 6–8 курсов по 10 дней комплексом Корилип для нормализации показателей ферментного статуса и самочувствия женщины.
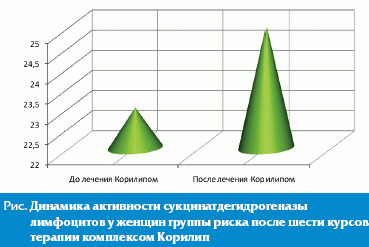
Выбор продолжительности курсов (10 дней) объясняется тем, что через 4–5 дней после начала приема препаратов наблюдается положительная динамика в цитохимическом статусе лейкоцитов, заключающаяся, в частности, в увеличении средней активности СДГ и альфа-ГФДГ и тенденции к нормализации остальных элементов структуры популяции. Количество назначаемых курсов определяется положительной динамикой цитохимических показателей и стабильностью их изменений. Как правило, необходимо не менее 6–8 курсов комплексом Корилип для нормализации показателей ферментного статуса и самочувствия женщины (рис.).
Для исследования степени напряжения энергетического метаболизма в ответ на введение комплекса суппозиториев Корилип использовалась проба с изоцитратом, СДГ (ИЗО) (М. Н. Кондрашова и соавт., 1987; С. В. Петричук и соавт., 1990). Известно, что в ответ на действие интенсивного внешнего раздражителя происходит резкое повышение выработки энергетических ресурсов в клетках организма, идущих на обеспечение ответной реакции. Для предотвращения чрезмерного расходования субстратов энергетического цикла и истощения митохондриальной активности существует защитный механизм блокирования основного митохондриального фермента — сукцинатдегидрогеназы. Данный блок инактивируется при проведении реакции по выявлению активности СДГ с добавлением изолимонной кислоты к основному субстрату. Повышение активности фермента в пробе с изолимонной кислотой, по сравнению с пробой на основном субстрате, свидетельствует о напряжении энергетического метаболизма. Для оценки степени напряжения энергетического метаболизма вычисляется коэффициент К:
Значение коэффициента К > 1 является неблагоприятным цитохимическим признаком, свидетельствует о напряжении клеточного метаболизма и о нестабильности митохондриальной мембраны. У условно здоровых пациентов значение коэффициента К составляет 80–90%.
Доказано, что в процессе лечения суппозиториями Корилип значение коэффициента К уменьшается и приближается к нормальным значениям (табл.).
Выводы
Литература
Ж. Х. Кушхова, кандидат медицинских наук
ГП № 153 УЗ СВАО, Москва
Кокарбоксилаза (Cocarboxylase)
Владелец регистрационного удостоверения:
Лекарственная форма
Форма выпуска, упаковка и состав препарата Кокарбоксилаза
| Лиофилизат для приготовления раствора для в/в и в/м введения | 1 амп. |
| кокарбоксилазы гидрохлорид | 50 мг |
Фармакологическое действие
Кофермент, образующийся в организме из тиамина. Оказывает метаболическое действие, активирует тканевой обмен. В организме фосфорилируется с образованием моно-, ди- и трифосфорных эфиров; кокарбоксилаза входит в состав ферментов, катализирующих карбоксилирование и декарбоксилирование кетокислот, пировиноградной кислоты, способствует образованию ацетил-коэнзима А, что определяет ее участие в углеводном обмене. Участие в пентозном цикле опосредованно способствует синтезу нуклеиновых кислот, белков и липидов.
Улучшает усвоение глюкозы, трофику нервной ткани, способствует нормализации функций сердечно-сосудистой системы.
Дефицит кокарбоксилазы вызывает повышение уровня пировиноградной и молочной кислот в крови, что приводит к ацидозу и ацидотической коме.
Фармакокинетика
После парентерального введения хорошо всасывается, в организме не депонирует. Экскретируется с мочой.
Показания активных веществ препарата Кокарбоксилаза
В составе комплексной терапии: печеночная и почечная недостаточность, диабетическая прекома и кома, диабетический кетоацидоз, хроническая сердечная недостаточность и нарушения сердечного ритма, периферические невриты.
У детей в период новорожденности: в составе комплексной терапии состояний, сопровождающихся гипоксией и ацидозом, в т.ч. асфиксия новорожденных, перинатальная гипоксическая энцефалопатия, недостаточность кровообращения, пневмония, сепсис.
Открыть список кодов МКБ-10
| Код МКБ-10 | Показание |
| E10.0 | Инсулинзависимый сахарный диабет с комой |
| E10.1 | Инсулинозависимый сахарный диабет с кетоацидозом |
| E11.0 | Инсулиннезависимый сахарный диабет с комой |
| E11.1 | Инсулиннезависимый сахарный диабет с кетоацидозом |
| I49.9 | Нарушение сердечного ритма неуточненное |
| I50.0 | Застойная сердечная недостаточность |
| K72 | Печеночная недостаточность, не классифицированная в других рубриках (в т.ч. печеночная кома, печеночная энцефалопатия) |
| M79.2 | Невралгия и неврит неуточненные |
| N18 | Хроническая болезнь почек |
| P21 | Асфиксия в родах |
| P23 | Врожденная пневмония |
| P29.0 | Сердечная недостаточность у новорожденного |
| P36 | Бактериальный сепсис новорожденного |
| P74.0 | Поздний метаболический ацидоз у новорожденного |
| P91.6 | Гипоксическая ишемическая энцефалопатия новорожденного |
Режим дозирования
Применяют в/м или в/в (струйно или капельно). Дозу, способ и схему применения, длительность терапии определяют индивидуально, в зависимости от показаний, клинической ситуации и возраста пациента.
Новорожденным детям вводят в/в медленно, дозу устанавливают из расчета на массу тела.
Побочное действие
Возможно: аллергические реакции (крапивница, кожный зуд).
При в/м введении: гиперемия, зуд, отек в месте инъекции.
Противопоказания к применению
Применение при беременности и кормлении грудью
Данные о безопасности кокарбоксилазы при применении у беременных женщин отсутствуют. В связи с недостаточным числом исследований не следует применять кокарбоксилазу при беременности и в период лактации (грудного вскармливания).
Применение при нарушениях функции печени
Применение при нарушениях функции почек
Возможно применение по показаниям в рекомендуемых дозах и схемах, при соблюдении рекомендуемого способа введения согласно показаниям и тяжести состояния.
Применение у детей
Возможно применение у детей по показаниям в рекомендуемых соответственно возрасту дозах и схемах. Новорожденным детям вводят в/в медленно, дозу устанавливают из расчета на массу тела.
Кокарбоксилаза : инструкция по применению
Лекарственная форма
Лиофилизат для приготовления раствора для внутривенного и внутримышечного введения 0,05 г, в комплекте с растворителем
Состав
Одна ампула препарата содержит:
Одна ампула растворителя содержит:
вода для инъекций – 2 мл
Описание
Лиофилизированный порошок или сухая пористая гигроскопичная масса белого цвета с характерным запахом.
Фармакотерапевтическая группа
Витамин В1 и его комбинации с витаминами В6 и В12. Витамин В1.
Фармакологические свойства
Кокарбоксилаза быстро абсорбируется после внутримышечного введения.
Проникает в большинство тканей организма. Подвергается метаболическому разложению. Продукты разложения экскретируются преимущественно почками.
Кокарбоксилаза – кофермент тиамина (витамина В1), в организме фосфорилируется с образованием моно-, ди- и трифосфорных эфиров, входит в состав ферментов, катализирующих карбоксилирование и декарбоксилирование альфа-кетокислот, пировиноградной кислоты, способствует образованию ацетил-кофермента А, что определяет ее участие в углеводном обмене. Экзогенный витамин В1 (тиамин) для участия в этих процессах должен путем фосфорилирования метаболизироваться в кокарбоксилазу – готовую форму кофермента. Следует учесть, что свойства кокарбоксилазы лишь частично адекватны таковым у тиамина; кокарбоксилазу не используют для профилактики и лечения гипо- и авитаминоза В1. Улучшает усвоение глюкозы, трофику нервной ткани, способствует нормализации функции сердечно-сосудистой системы. Дефицит кокарбоксилазы вызывает повышение уровня пировиноградной и молочной кислот в крови, что приводит к ацидозу и ацидотической коме.
Показания к применению
— комплексная терапия печеночной и почечной недостаточности;
— комплексная терапия диабетической прекомы и комы, диабетического кетоацидоза,
— комплексная терапия хронической сердечной недостаточности и нарушений сердечного ритма;
Детям препарат назначают по тем же показаниям. У новорожденных препарат применяют также в комплексной терапии состояний, связанных с гипоксией и ацидозом, в том числе асфиксии новорожденных, гипоксической энцефалопатии, недостаточности кровообращения, пневмонии, сепсиса и др.
Способ применения и дозы
Кокарбоксилазу вводят внутримышечно или внутривенно (струйно или капельно). Содержимое ампулы (0,05 г) растворяют непосредственно перед введением в 2 мл воды для инъекций. При внутривенном струйном введении объем доводят до 10-20 мл, при капельном введении до 200-400 мл, добавляя
0,9 % раствор натрия хлорида или раствор декстрозы (глюкозы).
При заболеваниях сердца назначают по 0,1-0,2 г в сутки в течение 15-30 дней.
При сахарном диабете (кетоацидоз, кома) суточная доза составляет 0,1 г.
При острой почечной и печеночной недостаточности вводят внутривенно струйно по 0,1- 0,15 г 3 раза в сутки или капельно (на 5 % растворе декстрозы) по 0,1-0,15 г в сутки.
При периферических невритах назначают внутримышечно в дозе 0,05-0,1 г в сутки в течение 1-1,5 мес.
Детям вводят внутримышечно, внутривенно (капельно или струйно). В зависимости от тяжести состояния и клинической симптоматики назначают от 0,025 до 0,050 г в сутки. Курс лечения от 3-7 до 15-30 дней. Новорожденным вводят внутривенно (медленно) 0,01 г на 1 кг массы тела один раз в сутки.
Побочные действия
— гиперемия, зуд, отек в месте инъекции (при внутримышечном введении).
Противопоказания
— повышенная чувствительность к препарату.
Лекарственные взаимодействия
Кокарбоксилаза усиливает эффект сердечных гликозидов и улучшает их переносимость.
Особые указания
Беременность и период лактации
В связи с отсутствием данных по безопасности и эффективности препарат не следует назначать беременным и кормящим грудью женщинам.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Передозировка
При применении в соответствии с назначением врача передозировки не возникает. Специфических антидотов нет. При осложнениях отменить прием препарата, проводить симптоматическую терапию.
Форма выпуска и упаковка
По 5 ампул с препаратом в комплекте с 5 ампулами воды для инъекций по 2 мл вместе с инструкцией по медицинскому применению на государственном и русском языках, а так же, при необходимости, ножом или скарификатором ампульным помещают в пачку из картона.
Условия хранения
Хранить в защищенном от света месте при температуре не выше 20 °С.
Хранить в недоступном для детей месте.
Срок хранения
Не использовать по истечении срока годности
Фетоплацентарная недостаточность: проблема современного акушерства
Фетоплацентарная недостаточность (ФПН) представляет собой симптомокомплекс, при котором возникают различные нарушения, как со стороны плаценты, так и со стороны плода, вследствие различных заболеваний и акушерских осложнений.
Фетоплацентарная недостаточность (ФПН) представляет собой симптомокомплекс, при котором возникают различные нарушения, как со стороны плаценты, так и со стороны плода, вследствие различных заболеваний и акушерских осложнений. Разнообразие вариантов проявления ФПН, частота и тяжесть осложнений для беременной и плода, преобладающее нарушение той или иной функции плаценты зависят от срока беременности, силы, длительности и характера воздействия повреждающих факторов, а также от стадии развития плода и плаценты, степени выраженности компенсаторно-приспособительных возможностей системы «мать–плацента–плод».
Причины возникновения ФПН
ФПН может развиваться под влиянием различных причин. Нарушения формирования и функции плаценты могут быть обусловлены заболеваниями сердца и сосудистой системы беременной (пороки сердца, недостаточность кровообращения, артериальная гипертензия и гипотензия), патологией почек, печени, легких, крови, хронической инфекцией, заболеваниями нейроэндокринной системы (сахарный диабет, гипо- и гиперфункция щитовидной железы, патология гипоталамуса и надпочечников) и целым рядом других патологических состояний. ФПН при анемии обусловлена снижением уровня железа как в материнской крови, так и в самой плаценте, что приводит к угнетению активности дыхательных ферментов и транспорта железа к плоду. При сахарном диабете нарушается метаболизм, выявляются гормональные расстройства и изменения иммунного статуса. Склеротическое поражение сосудов приводит к уменьшению поступления артериальной крови к плаценте. Важную роль в развитии ФПН играют различные инфекционные заболевания, особенно протекающие в острой форме или обостряющиеся во время беременности. Плацента может быть поражена бактериями, вирусами, простейшими и другими возбудителями инфекции.
Немаловажное значение в формировании ФПН имеет патология матки: эндометриоз, гипоплазия миометрия, пороки развития матки (седловидная, двурогая). Фактором риска ФПН следует считать миому матки. Однако риск ФПН у беременных с миомой матки различен. К группе с высоким риском относят первородящих в возрасте 35 лет и старше с преимущественно межмышечным расположением миоматозных узлов больших размеров, особенно при локализации плаценты в области расположения опухоли. Группу с низким риском ФПН составляют молодые женщины до 30 лет без тяжелых экстрагенитальных заболеваний, с небольшими миоматозными узлами преимущественно подбрюшинного расположения в дне и теле матки.
Среди осложнений беременности, наиболее часто сопутствующих ФПН, ведущее место занимает гестоз. Угрозу прерывания беременности следует одновременно рассматривать и как причину, и как следствие ФПН. В связи с различной этиологией ФПН при угрозе прерывания беременности патогенез этого осложнения имеет различные варианты, а прогноз для плода зависит от степени развития защитно-приспособительных реакций. При низком расположении или предлежании плаценты васкуляризация субплацентарной зоны снижена. Более тонкая стенка нижнего сегмента матки не обеспечивает необходимых условий для достаточной васкуляризации плацентарного ложа и его нормального функционирования.
Относительно часто при данной патологии происходит отслойка плаценты, сопровождающаяся кровопотерей. Многоплодная беременность представляет естественную модель ФПН в результате неадекватного обеспечения потребностей двух и более плодов. В основе ФПН при изосерологической несовместимости крови матери и плода чаще всего лежат процессы нарушения созревания плаценты. У плода развивается анемия и гипоксия, возникает задержка развития из-за нарушений процессов синтеза белка и снижения активности ферментов. Функциональное состояние плаценты во многом обусловлено степенью ее развития в соответствии с гестационным сроком и сохранностью защитно-приспособительных механизмов. Соответствие зрелости плаценты гестационному сроку является одним из наиболее важных условий обеспечения адекватного развития плода и его защиты. Несомненно, что поздний возраст беременной (старше 35 лет) или, наоборот, юный возраст (до 17 лет), отягощенный анамнез (аборты, воспалительные заболевания), вредные привычки, воздействие неблагоприятных факторов окружающей среды, плохое питание, социальная незащищенность и бытовая неустроенность также способствуют осложненному формированию плаценты и нарушению ее функции [1].
Клиническая практика и результаты научных исследований свидетельствуют о многофакторной природе ФПН. В связи с этим практически невозможно выделить какой-либо единственный фактор развития данного осложнения. Перечисленные патологические состояния не в одинаковой мере оказывают влияние на развитие ФПН. Чаще всего в развитии этой патологии участвуют несколько этиологических факторов, один из которых может быть ведущим. Патологические изменения, которые происходят при ФПН, приводят к уменьшению маточно-плацентарного и фетоплацентарного кровотока; снижению артериального кровоснабжения плаценты и плода; ограничению газообмена и метаболизма в фетоплацентарном комплексе; нарушению процессов созревания плаценты; снижению синтеза и дисбалансу гормонов плаценты. Все эти изменения подавляют компенсаторно-приспособительные возможности системы «мать–плацента–плод», замедляют рост и развитие плода, обусловливают осложненное течение беременности и родов (угроза преждевременного прерывания беременности, гестоз, преждевременные и запоздалые роды, аномалии родовой деятельности, преждевременная отслойка плаценты и др.) [5].
В результате воздействия повреждающих факторов и реализации патогенетических механизмов, приводящих к ФПН, закономерно развивается гипоксия плода. На начальных ее этапах у плода активизируются вазопрессорные факторы, повышается тонус периферических сосудов, отмечается тахикардия, увеличивается частота дыхательных движений, повышается двигательная активность, возрастает минутный объем сердца.
Дальнейшее прогрессирование гипоксии приводит к смене тахикардии брадикардией, появляется аритмия, уменьшается минутный объем сердца. Адаптационной реакцией на гипоксию является перераспределение крови в пользу мозга, сердца и надпочечников с одновременным уменьшением кровоснабжения остальных органов. Параллельно угнетается двигательная и дыхательная активность плода [5].
Классификация ФПН
ФПН целесообразно классифицировать с учетом состояния защитно-приспособительных реакций на компенсированную, субкомпенсированную, декомпенсированную [3].
Компенсированная форма ФПН характеризуется начальными проявлениями патологического процесса в фетоплацентарном комплексе. Защитно-приспособительные механизмы активизируются и испытывают определенное напряжение, что создает условия для дальнейшего развития плода и прогрессирования беременности. При адекватной терапии и ведении родов возможно рождение здорового ребенка.
Субкомпенсированная форма ФПН характеризуется усугублением тяжести осложнения. Защитно-приспособительные механизмы испытывают предельное напряжение (возможности фетоплацентарного комплекса при этом практически исчерпаны), что не позволяет обеспечить их реализацию в достаточной степени для адекватного течения беременности и развития плода. Увеличивается риск возникновения осложнений для плода и новорожденного.
При декомпенсированной форме ФПН имеет место перенапряжение и срыв компенсаторно-приспособительных механизмов, которые уже не обеспечивают необходимых условий для дальнейшего нормального прогрессирования беременности. В фетоплацентарной системе происходят необратимые морфофункциональные нарушения. Существенно возрастает риск развития тяжелых осложнений для плода и новорожденного (включая их гибель). Клиническая картина ФПН проявляется в нарушениях основных функций плаценты.
Задержка внутриутробного развития плода
Об изменении дыхательной функции плаценты свидетельствуют в основном симптомы гипоксии плода. При этом вначале беременная обращает внимание на повышенную (беспорядочную) двигательную активность плода, затем на ее уменьшение или полное отсутствие. Наиболее характерным признаком хронической ФПН является задержка внутриутробного развития плода. Клиническим проявлением задержки внутриутробного развития плода является уменьшение размеров живота беременной (окружность живота, высота стояния дна матки) по сравнению с нормативными показателями, характерными для данного срока беременности.
При симметричной форме задержки внутриутробного развития, которая развивается с ранних сроков беременности, отмечается пропорциональное отставание длины и массы тела плода. При этом количественные показатели фетометрии имеют более низкие значения по сравнению с индивидуальными колебаниями, характерными для данного срока беременности.
Асимметричная форма задержки внутриутробного развития характеризуется непропорциональным развитием плода. Эта форма чаще всего возникает во II или в III триместре беременности и проявляется отставанием массы тела плода при нормальной его длине. Преимущественно уменьшаются размеры живота и грудной клетки плода, что связано с отставанием развития паренхиматозных органов (в первую очередь печени) и подкожной жировой клетчатки. Размеры головы и конечностей плода соответствуют показателям, характерным для данного срока беременности.
Нарушения функций плаценты
Отражением нарушений защитной функции плаценты при ослаблении плацентарного барьера является внутриутробное инфицирование плода под действием проникающих через плаценту патогенных микроорганизмов. Возможно также проникновение через плацентарный барьер различных токсичных веществ, также оказывающих повреждающее действие на плод.
Изменение синтетической функции плаценты сопровождается дисбалансом уровня вырабатываемых ею гормонов и снижением синтеза белков, что проявляется задержкой внутриутробного развития плода, гипоксией, патологией сократительной активности матки при беременности и в родах (длительная угроза преждевременного прерывания беременности, преждевременные роды, аномалии родовой деятельности).
Длительное и частое повышение тонуса миометрия приводит к снижению артериального притока крови к плаценте и вызывает венозный застой. Гемодинамические нарушения снижают газообмен между организмом матери и плода, что затрудняет поступление к плоду кислорода, питательных веществ, выведение продуктов метаболизма, способствует нарастанию гипоксии плода.
Нарушение эндокринной функции плаценты может приводить и к перенашиванию беременности. Снижение гормональной активности плаценты вызывает нарушение функции влагалищного эпителия, создавая благоприятные условия для развития инфекции, обострения или возникновения воспалительных заболеваний урогенитального тракта. На фоне расстройства выделительной функции плаценты и околоплодных оболочек отмечается патологическое количество околоплодных вод — чаще всего маловодие, а при некоторых патологических состояниях (сахарный диабет, отечная форма гемолитической болезни плода, внутриутробное инфицирование и др.) — многоводие.
Диагностика ФПН
На начальном этапе развития ФПН перечисленные клинические признаки могут быть выражены слабо или отсутствовать. В связи с этим существенное значение приобретают методы лабораторного и инструментального динамического контроля за состоянием фетоплацентарного комплекса в группе высокого риска по развитию ФПН. Доминирующее положение в клинической картине могут занимать признаки основного заболевания или осложнения, при котором развилась ФПН. Степень выраженности ФПН и нарушения компенсаторно-приспособительных механизмов находятся в прямой зависимости от тяжести основного заболевания и длительности его течения. Наиболее тяжелое течение ФПН приобретает при появлении патологических признаков в срок беременности до 30 недель и ранее. Таким образом, наиболее полную информацию о форме, характере, степени тяжести ФПН и выраженности компенсаторно-приспособительных реакций позволяют получить данные комплексной динамической диагностики [2].
С учетом многофакторной этиологии и патогенеза ФПН ее диагностика должна быть основана на комплексном обследовании пациентки. Для установления диагноза ФПН и выявления причин этого осложнения значительное внимание следует уделять правильному сбору анамнеза. При опросе оценивают возраст пациентки (поздний или юный возраст первородящей женщины), особенности ее здоровья, перенесенные экстрагенитальные, нейроэндокринные и гинекологические заболевания, хирургические вмешательства, наличие вредных привычек, выясняют профессию, условия и образ жизни.
Большое значение имеет информация об особенностях менструальной функции, периоде ее становления, количестве и течении предшествующих беременностей. Нарушения менструальной функции являются отражением патологии нейроэндокринной регуляции репродуктивной функции. Важно оценить течение настоящей беременности, характер акушерских осложнений и, главное, наличие заболеваний, на фоне которых развивается беременность (артериальная гипертензия или гипотония, патология почек, печени, сахарный диабет, анемия и др.). Следует обратить внимание на жалобы беременной: увеличение или угнетение двигательной активности плода, боли внизу живота, повышение тонуса матки, появление нетипичных выделений из половых путей, которые могут сопровождаться неприятным запахом и зудом.
При объективном исследовании пальпаторно оценивают состояние тонуса матки. Измеряют высоту стояния дна матки и окружности живота, сопоставляют их с массой тела и ростом беременной, а также уточненным сроком беременности. Такие измерения являются важными и в то же время наиболее простыми показателями для диагностики задержки внутриутробного развития плода, маловодия и многоводия. При наружном осмотре половых органов и при исследовании с помощью зеркал необходимо обратить внимание на наличие признаков воспаления, характер выделений из половых путей, взять материал со стенки влагалища, из цервикального канала и из уретры для микробиологического и цитологического исследования [2].
При эхографическом исследовании определяют размеры плода (размеры головы, туловища и конечностей) и сопоставляют их с нормативными показателями, характерными для предполагаемого гестационного срока. Основой ультразвуковой диагностики для уточнения соответствия размеров плода предполагаемому сроку беременности и выявления задержки внутриутробного развития плода является сопоставление фетометрических показателей с нормативными данными. Непременным условием является оценка анатомических структур плода для выявления аномалий его развития. Эхографическое исследование включает в себя и плацентографию. При этом определяют локализацию плаценты, толщину плаценты, расстояние плаценты от внутреннего зева, соответствие степени зрелости плаценты гестационному сроку, патологические включения в структуре плаценты, расположение плаценты по отношению к миоматозным узлам или рубцу на матке. В процессе исследования проводят оценку объема околоплодных вод, строения пуповины и расположения петель пуповины [4].
Допплерография представляет собой высокоинформативный, относительно простой и безопасный метод диагностики, который можно использовать для комплексного динамического наблюдения за состоянием кровообращения в системе «мать–плацента–плод» после 18–19 недель беременности, так как к этому времени завершается вторая волна инвазии цитотрофобласта. Характер гемодинамики в артериях пуповины позволяет судить о состоянии фетоплацентарного кровотока и о микроциркуляции в плодовой части плаценты. Для диагностики нарушения маточно-плацентарного кровотока проводят исследования в маточных артериях с двух сторон [4].
Важной составной частью комплексной оценки состояния плода является кардиотокография (КТГ), которая представляет собой метод функциональной оценки состояния плода на основании регистрации частоты его сердцебиений и их изменений в зависимости от сокращений матки, действия внешних раздражителей или активности самого плода. КТГ значительно расширяет возможности антенатальной диагностики, позволяя решать вопросы рациональной тактики ведения беременности.
Окончательная тактика ведения пациентки должна быть выработана не только на основе оценки отдельных показателей состояния фетоплацентарного комплекса, но и с учетом индивидуальных особенностей конкретного клинического наблюдения (срок и осложнения беременности, сопутствующая соматическая патология, результаты дополнительного комплексного обследования, состояние и готовность организма к родам и т. д.).
Лечение беременных с ФПН
При выявлении ФПН беременную целесообразно госпитализировать в стационар для углубленного обследования и лечения. Исключение могут составлять беременные с компенсированной формой ФПН при условии, что начатое лечение дает положительный эффект и имеются необходимые условия для динамического клинического и инструментального контроля за характером течения беременности и эффективностью проводимой терапии. Ведущее место в проведении лечебных мероприятий занимает лечение основного заболевания или осложнения, при котором возникла ФПН. В настоящее время, к сожалению, не представляется возможным полностью избавить беременную от ФПН какими-либо лечебными воздействиями. Применяемые средства терапии могут способствовать только стабилизации имеющегося патологического процесса и поддержанию компенсаторно-приспособительных механизмов на уровне, позволяющем обеспечить продолжение беременности до возможного оптимального срока родоразрешения.
Основу терапии плацентарной недостаточности составляют мероприятия, направленные на улучшение маточно-плацентарного и фетоплацентарного кровотока. Препараты, применяемые с этой целью, расширяют сосуды, расслабляют мускулатуру матки, улучшают реологические свойства крови в системе «мать–плацента–плод» [2].
Лечение ФПН должно быть направлено на улучшение маточно-плацентарного и фетоплацентарного кровотока; интенсификацию газообмена; коррекцию реологических и коагуляционных свойств крови; устранение гиповолемии и гипопротеинемии; нормализацию сосудистого тонуса и сократительной активности матки; усиление антиоксидантной защиты; оптимизацию метаболических и обменных процессов. Стандартной схемы лечения ФПН существовать не может вследствие индивидуального сочетания этиологических факторов и патогенетических механизмов развития данного осложнения. Подбор препаратов следует проводить индивидуально и дифференцированно в каждом конкретном наблюдении с учетом степени тяжести и длительности осложнения, этиологических факторов и патогенетических механизмов, лежащих в основе этой патологии. Индивидуального подхода требуют дозировка препаратов и продолжительность их применения. Следует обращать внимание на коррекцию побочного действия некоторых лекарственных средств.
В патогенезе плацентарной недостаточности, также как и при гестозе, основным является дисфункция эндотелия. При этом имеется три эндотелиальные системы: матери, плаценты и плода. Поэтому процессы, происходящие в сосудисто-тромбоцитарном звене при плацентарной недостаточности, сходны с теми, которые имеют место при гестозе. А это приводит к метаболическим нарушениям в системе «мать–плацента–плод» и к гипотрофии плода.
Потребность в магнии при беременности возрастает в 2–3 раза за счет роста и развития плода и плаценты. Магний, участвующий в более чем 300 ферментативных реакциях, необходим для роста плода. Ионы магния задействованы в синтезе ДНК и РНК. Удачно сочетание магния с пиридоксином, который обеспечивает белковый обмен, являясь катионом более 50 ферментативных реакций, участвуя в синтезе и всасывании аминокислот, способствует образованию гемоглобина в эритроцитах, что особенно важно для растущего эмбриона и плода. Поэтому при наличии плацентарной недостаточности и гипотрофии плода наиболее целесообразно применять препараты магния.
Магний (Магне B6® форте) оказывает положительное действие на маточно-плацентарное кровообращение, поэтому показано его назначение для лечения плацентарной недостаточности и гипотрофии плода. Установлен параллелизм между концентрацией магния в сыворотке крови, в миометрии, в плаценте.
Магне В6® форте хорошо сочетается также с ангиопротекторами, ангиоактивными средствами (Трентал, Курантил, Милдронат, Актовегин и др.), с антиоксидантами — витаминами Е, С, группы В и т. д.
При лечении угрозы прерывания беременности и плацентарной недостаточности магнезиальная терапия может сочетаться с применением витамина Е и других антиоксидантов, с Милдронатом, Актовегином, с блокаторами кальциевых каналов (верапамилом), Эуфиллином, Папаверином, Дибазолом, Но-шпой, антигистаминными препаратами, физиотерапевтическими методами лечения (центральная электроаналгезия, индуктотерапия околопочечной области, гидроионизация и др.).
Лечение ФПН начинают и проводят в стационаре не менее 4 недель с последующим ее продолжением в женской консультации. Общая длительность лечения составляет не менее 6–8 недель. Для оценки эффективности проводимой терапии осуществляют динамический контроль с помощью клинических, лабораторных и инструментальных методов исследования. Важным условием успешного лечения ФПН является соблюдение беременной соответствующего режима: полноценный отдых не менее 10–12 часов в сутки, устранение физических и эмоциональных нагрузок, рациональное сбалансированное питание.
Одним из ведущих патогенетических механизмов развития ФПН являются нарушения маточно-плацентарного и фетоплацентарного кровотока, сопровождающиеся повышением вязкости крови, гиперагрегацией эритроцитов и тромбоцитов, расстройством микроциркуляции и сосудистого тонуса, недостаточностью артериального кровообращения. Поэтому важное место в лечении ФПН занимают препараты антиагрегантного и антикоагулянтного действия, а также лекарственные средства, нормализующие сосудистый тонус.
Следует принимать во внимание, что периодическое и длительное повышение тонуса матки способствует нарушению кровообращения в межворсинчатом пространстве вследствие снижения венозного оттока. В связи с этим в курсе терапии ФПН у пациенток с явлениями угрозы прерывания беременности оправдано назначение препаратов токолитического действия.
Таким образом, плацентарная недостаточность развивается при осложненной беременности, что требует проведения лечебно-профилактических мероприятий, направленных на снижение акушерской патологии. Проблема лечения плацентарной недостаточности остается пока до конца не решенной, поэтому коррекция нарушений должна быть начата лучше до наступления беременности, что может позволить снизить частоту осложнений беременности, плода и новорожденного.
Литература
В. Н. Кузьмин, доктор медицинских наук, профессор